
科目: 來源:2015屆湖北省荊門市高二上學期期末質量檢測化學試卷(解析版) 題型:選擇題
下列表述中正確的是
A.任何能使熵值增大的過程都能自發進行
B.△H<0,△S>0的化學反應一定能自發進行
C.已知熱化學方程式2SO2(g)+O2(g) 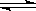 2SO3(g) △H=-QkJ·mol-1(Q>0),則將2mol SO2(g) 和1mol O2(g) 置于一密閉容器中充分反應后放出Q kJ的熱量
2SO3(g) △H=-QkJ·mol-1(Q>0),則將2mol SO2(g) 和1mol O2(g) 置于一密閉容器中充分反應后放出Q kJ的熱量
D.稀溶液中1mol NaOH分別和1mol CH3COOH、1molHNO3反應,兩者放出的熱量一樣多
查看答案和解析>>
科目: 來源:2015屆湖北省荊門市高二上學期期末質量檢測化學試卷(解析版) 題型:選擇題
下列說法或表示方法正確的是
A.若將等量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量多
B.由“C(石墨)=C(金剛石) ΔH=1.9kJ/mol”可知,金剛石比石墨穩定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,若將含1molCH3COOH與含1mol NaOH的溶液混合,放出的熱量小于57.3kJ
D.在101kPa時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,氫氣燃燒的熱化學方程式表示為:2H2(g)+O2(g)=2H2O(l) ΔH=—285.8kJ/mol
查看答案和解析>>
科目: 來源:2015屆湖北省荊門市高二上學期期末質量檢測化學試卷(解析版) 題型:選擇題
蓋斯定律認為:不管化學過程是一步或分為數步完成,這個過程的熱效應是相同的。
已知:H2O(g)= H2O(l) △H1 =-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l) △H2 =-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3 = -Q3 kJ·mol-1(Q3>0)若使23g液態乙醇完全燃燒,最后恢復到室溫,則放出的熱量為(kJ)
A.Q1+ Q2+Q3 B.0.5(Q1+Q2+Q3 )
C.0.5 Q1-1.5 Q2+0.5Q3 D.1.5 Q1-0.5 Q2+0.5Q3
查看答案和解析>>
科目: 來源:2015屆湖北省荊門市高二上學期期末質量檢測化學試卷(解析版) 題型:選擇題
在一定溫度條件下,對于已達到平衡的反應:
FeCl3 +3KSCN  3KCl+Fe(SCN)3 ,在此溶液中作如下處理,平衡左移的是
3KCl+Fe(SCN)3 ,在此溶液中作如下處理,平衡左移的是
A.加入少量氯化鉀固體 B.加入少量氯化鐵固體
C.減少Fe(SCN)3的濃度 D.加水稀釋
查看答案和解析>>
科目: 來源:2015屆湖北省荊門市高二上學期期末質量檢測化學試卷(解析版) 題型:選擇題
一定溫度下,在氫氧化鈣的懸濁液中,存在氫氧化鈣固體與其電離出的離子間溶解結晶平衡:Ca(OH)2(s)  Ca2+(aq)+2OHˉ(aq)。向此種懸濁液中加入少量的氧化鈣粉末,充分反應后恢復到原溫度。下列敘述正確的是
Ca2+(aq)+2OHˉ(aq)。向此種懸濁液中加入少量的氧化鈣粉末,充分反應后恢復到原溫度。下列敘述正確的是
A.溶液中鈣離子數目減小 B.溶液中鈣離子濃度減少
C.溶液中氫氧根離子濃度增大 D.pH減小
查看答案和解析>>
科目: 來源:2015屆湖北省荊門市高二上學期期末質量檢測化學試卷(解析版) 題型:選擇題
在蒸發皿中加熱蒸干并灼燒下列物質的溶液,可以得到該物質的是
A.硫酸鎂 B.碳酸氫鈉 C.氯化鋁 D.鹽酸溶液
查看答案和解析>>
科目: 來源:2015屆湖北省荊門市高二上學期期末質量檢測化學試卷(解析版) 題型:選擇題
下列能正確表示水解的離子方程式是
A.CH3COOH + H2O  CH3COO- + H3O+
CH3COO- + H3O+
B.NH4+ + H2O  NH3·H2O + H+
NH3·H2O + H+
C.CO32- + 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
D.Br- + H2O  HBr + OH-
HBr + OH-
查看答案和解析>>
科目: 來源:2015屆湖北省荊門市高二上學期期末質量檢測化學試卷(解析版) 題型:選擇題
在pH都等于9的NaOH和CH3COONa兩種溶液中,設由水電離產生的OH-離子濃度分別為A mol·L-1與B mol·L-1,則A和B的關系為
A.A>B B.A=10-4B C.B=10-4A D.A=B
查看答案和解析>>
科目: 來源:2015屆湖北省荊門市高二上學期期末質量檢測化學試卷(解析版) 題型:選擇題
用惰性電極電解下列溶液,一段時間后,停止電解,向溶液中加入一定質量的另一種物質(括號內),能使溶液完全復原的是
A.CuCl2 (CuO) B.NaOH (NaOH)
C.CuSO4 (CuCO3) D.NaCl (NaOH)
查看答案和解析>>
科目: 來源:2015屆湖北省荊門市高二上學期期末質量檢測化學試卷(解析版) 題型:選擇題
汽車等機動車輛的啟動電源常用鉛蓄電池,放電時的電池反應如下:
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根據此反應判斷下列敘述中正確的是
A.PbO2是電池的負極
B.負極的電極反應式為:Pb+SO42--2e-=PbSO4
C.PbO2得電子,被氧化
D.電池放電時,溶液酸性增強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com