
科目: 來源:2012年普通高等學校招生全國統一考試化學(新課標解析版) 題型:選擇題
下列敘述中正確的是
A.醫用酒精的濃度通常為95%
B.單質硅是將太陽能轉變為電能的常用材料
C.淀粉、纖維素和油脂都屬于天然高分子化合物
D.合成纖維和光導纖維都是新型無機非金屬材料
查看答案和解析>>
科目: 來源:2012年普通高等學校招生全國統一考試化學(新課標解析版) 題型:選擇題
NA表示阿伏伽德羅常數的值,下列敘述中不正確的是
A.分子總數為NA的NO2和CO2的混合氣體中含有的氧原子數為2NA
B.28g乙烯和環丁烷(C4H8)的混合氣體中含有的碳原子數為2NA
C.常溫常壓下,92g的NO2和N2O4混合氣體含有的原子數為6NA
D.常溫常壓下,22.4L氯氣與足量鎂粉充分反應,轉移的電子數為2NA
查看答案和解析>>
科目: 來源:2012年普通高等學校招生全國統一考試化學(新課標解析版) 題型:選擇題
分子式為C5H12O且可與金屬鈉反應放出氫氣的有機化合物有(不考慮立體異構)
A.5種 B.6種 C.7種 D.8種
查看答案和解析>>
科目: 來源:2012年普通高等學校招生全國統一考試化學(新課標解析版) 題型:選擇題
已知溫度T時水的離子積常數為KW,該溫度下,將濃度為amol·L-1 的一元酸HA與bmol·L-1的一元堿BOH等體積混合,可判定該溶液呈中性的依據是
A.a=b
B.混合溶液的PH=7
C.混合溶液中,c(H+)= 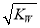 mol.L-1
mol.L-1
D.混合溶液中c(H+)+c(B+)=c(OH-)+C(A-)
查看答案和解析>>
科目: 來源:2012年普通高等學校招生全國統一考試化學(新課標解析版) 題型:選擇題
分析下表中各項的排布規律,按此規律排布第26項應為

A.C7H16 B.C7H14O2 C.C8H18 D.C8H18O
查看答案和解析>>
科目: 來源:2012年普通高等學校招生全國統一考試化學(新課標解析版) 題型:選擇題
短周期元素W、X、Y、Z的原子序數依次增大,其中W的陰離子的核外電子數與X、Y、Z原子的核外內層電子數相同。X的一種核素在考古時常用來鑒定一些文物的年代,工業上采用液態空氣分餾方法來生產Y的單質,而Z不能形成雙原子分子。根據以上敘述,下列說法中正確的是
A.上述四種元素的原子半徑大小為W<X<Y<Z
B.W、X、Y、Z原子的核外最外層電子數的總和為20
C.W與Y可形成既含極性共價鍵又含非極性共價鍵的化合物
D.由W與X組成的化合物的沸點總低于由W與Y祖傳的化合物的沸點
查看答案和解析>>
科目: 來源:2012年普通高等學校招生全國統一考試化學(新課標解析版) 題型:簡答題
(14分)鐵是應用最廣泛的金屬,鐵的鹵化物、氧化物以及高價鐵的含氧酸鹽均為重要化合物。
(1)要確定鐵的某氯化物FeClx的化學式,可用離子交換和滴定的方法。實驗中稱取0.54g的FeClx樣品,溶解后先進行陽離子交換預處理,再通過含有飽和OH-的陰離子交換柱,使Cl-和OH-發生交換。交換完成后,流出溶液的OH-用0.40mol.L-1的鹽酸滴定,滴至終點時消耗鹽酸25.0mL。計算該樣品中氯的物質的量,并求出FeClx中x值:
(列出計算過程);
(2)現有一含有FeCl2和FeCl3的混合物樣品,采用上述方法測得n(Fe):n(Cl)=1:2.1,則該樣品中FeCl3的物質的量分數為 。在實驗室中,FeCl2可用鐵粉和 鹽酸反應制備,FeCl3可用鐵粉和 反應制備;
(3)FeCl3與氫碘酸反應時可生成棕色物質,該反應的離子方程式為
(4)高鐵酸鉀(K2FeO4)是一種強氧化劑,可作為水處理劑和高容量電池材料。FeCl3與KClO在強堿性條件下反應可制取K2FeO4,其反應的離子方程式為
與MnO2-Zn電池類似,K2FeO4-Zn也可以組成堿性電池,K2FeO4在電池中作為正極材料,其電極反應式為 ,該電池總反應的離子方程式為 。
查看答案和解析>>
科目: 來源:2012年普通高等學校招生全國統一考試化學(新課標解析版) 題型:簡答題
(15分)光氣(COCl2)在塑料、制革、制藥等工業中有許多用途,工業上采用高溫下CO與Cl2在活性炭催化下合成。
(1)實驗室常用來制備氯氣的化學方程式為 ;
(2)工業上利用天然氣(主要成分為CH4)與CO2進行高溫重整制備CO,已知CH4、H2、和CO的燃燒熱(ΔH)分別為-890.3kJ·mol-1、-285.8kJ.mol-1和-283.0kJ.mol-1,則生成1m3(標準狀況)CO所需熱量為 ;
(3)實驗室中可用氯仿(CHCl3)與雙氧水直接反應制備光氣,其反應的化學方程式為
;
(4)COCl2的分解反應為COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反應體系達到平衡后,各物質的濃度在不同條件下的變化狀況如下圖所示(第10min到14min的COCl2濃度變化曲線未示出):
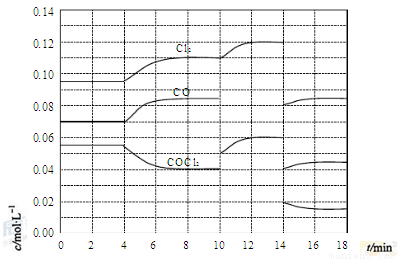
①計算反應在第8min時的平衡常數K= ;
②比較第2min反應溫度T(2)與第8min反應溫度T(8)的高低:T(2) T(8)
(填“<”、“>”或“=”),
③若12min時反應于溫度T(8)下重新達到平衡,則此時c(COCl2)= mol·L-1;
④比較產物CO在2-3min、5-6min和12-13min時平均反應速率(平均反應速率分別以v(2-3)、v(5-6)、v(12-13))的大小 ;
⑤比較反應物COCl2在5-6min和15-16min時平均反應速率的大小:v(5-6) v(15-16)(填“<”、“>”或“=”),原因是 。
查看答案和解析>>
科目: 來源:2012年普通高等學校招生全國統一考試化學(新課標解析版) 題型:實驗題
(14分)溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如下:
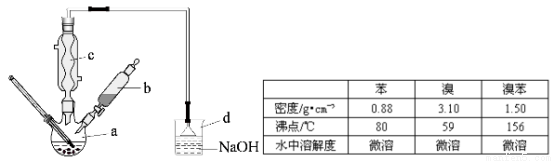
按下列合成步驟回答問題:
(1)在a中加入15mL無水苯和少量鐵屑,在b中小心加入4.0mL液態溴,向a中滴入幾滴溴,有白色煙霧產生,是因為生成了 氣體。繼續滴加至液溴滴完,裝置d的作用是 ;
(2)液溴滴完后,經過下列步驟分析提純:
①向a中加入10mL水,然后過濾除去未反應的鐵屑;
②濾液依次用10mL水、8mL10%的NaOH溶液、10mL水洗滌。NaOH溶液洗滌的作用是 ③向分出的粗溴苯中加入少量的無水氯化鈣,靜置、過濾,加入氯化鈣的是 ;
(3)經以上分離操作后,粗溴苯中還含有的主要雜質為 ,要進一步提純,下列操作中必須的是 (填入正確選項前的字母);
A.重結晶 B.過濾 C.蒸餾 D.萃取
(4)在該實驗中,a的容積最適合的是 (填入正確選項前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
科目: 來源:2012年普通高等學校招生全國統一考試化學(新課標解析版) 題型:簡答題
【選修2化學與技術】(15分)
由黃銅礦(主要成分是CuFeS2)煉制精銅的工藝流程示意圖如下:

(1)在反射爐中,把銅精礦砂和石英砂混合加熱到1000℃左右,黃銅礦與空氣反應
生成Cu和Fe的低價硫化物,且部分Fe的硫化物轉變為低價氧化物。該過程中兩個主
要反應的化學方程式分別是 、
,反射爐內生成爐渣的主要成分是 ;
(2)冰銅(Cu2S和FeS互相熔合而成)含Cu量為20%--50%。轉爐中,將冰銅加
熔劑(石英砂)在1200℃左右吹入空氣進行吹煉。冰銅中的Cu2S被氧化為Cu2O,生成Cu2O與Cu2S反應,生成含Cu量約為98.5%的粗銅,該過程發生反應的化學方程式分別是 、 ;
(3)粗銅的電解精煉如右圖所示。在粗銅的電解過程中,粗銅板應是圖中電極_ _(填圖中的字母);在電極d上發生的電極反應式為 ;若粗銅中還含有Au、Ag、Fe,它們在電解槽中的存在形式和位置為 。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com