
科目: 來源:不詳 題型:填空題
 CH3OH(g)
CH3OH(g)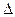 H1
H1 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)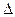 H2
H2| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
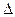 H1 0(填“>”“=”或“<”);
H1 0(填“>”“=”或“<”); 到某時刻測得各組分的濃度如下:
到某時刻測得各組分的濃度如下:| 物質 | H2 | CO | CH3OH |
| 濃度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目: 來源:不詳 題型:單選題

| A.a、b、c、d四個點中,只有b點的化學反應處于平衡狀態 |
| B.前10 min內用υ(NO2)表示的化學反應速率為0.04 mol/(L·min) |
| C.25 min時,導致平衡移動的原因是升高溫度 |
| D.a點,用υ(NO2)表示的化學反應速率等于用υ(N2O4)表示的化學反應速率 |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
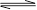 2NO+O2,此反應達到平衡狀態時的標志是( )
2NO+O2,此反應達到平衡狀態時的標志是( )| A.混合氣體的顏色變淺 |
| B.混合氣體的密度不再變化 |
| C.混合氣中NO2、NO、O2物質的量之比為2:2:1 |
| D.單位時間內生成2n mol NO,同時生成2n mol NO2 |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
|
查看答案和解析>>
科目: 來源:不詳 題型:單選題
 C(g) +2D(g) △H<0在一定條件下達到平衡,下列有關敘述正確的是( )
C(g) +2D(g) △H<0在一定條件下達到平衡,下列有關敘述正確的是( )| A.①② | B.④ | C.③ | D.④⑤ |
查看答案和解析>>
科目: 來源:不詳 題型:填空題
 Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0  2SO3經10min后反應達平衡時有3molSO3生成。試計算:
2SO3經10min后反應達平衡時有3molSO3生成。試計算:查看答案和解析>>
科目: 來源:不詳 題型:填空題
 2NH3(g);△H<0他因此獲得了1918年諾貝爾化學獎。工業上合成氨的部分工藝流程如下:
2NH3(g);△H<0他因此獲得了1918年諾貝爾化學獎。工業上合成氨的部分工藝流程如下: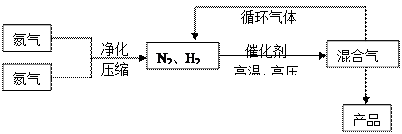
| 氣體 | 氮氣 | 氫氣 | 氨 |
| 熔點(℃) | -210.01 | -252.77 | -77.74 |
| 沸點(℃) | -1 95.79 95.79 | -259.23 | -33.42 |
 (1)操作的目的:
(1)操作的目的:  2NH3(g),在673K,30MPa下n(NH3)和n(H2)隨時間變化的關系如下圖所示。下列敘述正確的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)隨時間變化的關系如下圖所示。下列敘述正確的是
查看答案和解析>>
科目: 來源:不詳 題型:填空題
 2C(g) +2D(g),2 min 末反應達到平衡狀態,生成0.8 mol D,請填寫下面空白:
2C(g) +2D(g),2 min 末反應達到平衡狀態,生成0.8 mol D,請填寫下面空白:查看答案和解析>>
科目: 來源:不詳 題型:單選題
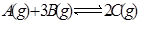 達到平衡的標志的是( )
達到平衡的標志的是( )查看答案和解析>>
科目: 來源:不詳 題型:單選題
 CO2(g)+H2(g) ΔH1="-41.2" kJ/mol
CO2(g)+H2(g) ΔH1="-41.2" kJ/mol 2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol
2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol CO(g)+3H2(g) ΔH3
CO(g)+3H2(g) ΔH3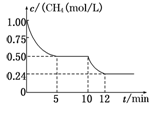
| A.ΔH3=+206.1 kJ/mol |
| B.反應③進行到10 min時,改變的外界條件可能是升高溫度 |
| C.反應③進行的過程中,0~5 min這段時間共吸收的熱量為103.05 kJ |
| D.當反應③平衡后,向容器中通入CH4,平衡向正反應方向移動,CH4的轉化率將增大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com