
科目: 來源:不詳 題型:單選題
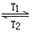 WI2(g) ΔH<0(溫度T1<T2)。下列說法正確的是
WI2(g) ΔH<0(溫度T1<T2)。下列說法正確的是| A.燈管工作時,擴散到燈絲附近高溫區的WI2(g)會分解出W,W重新沉積到燈絲上 |
| B.燈絲附近溫度越高,WI2(g)的轉化率越低 |
C.該反應的平衡常數表達式是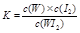 |
| D.利用該反應原理可以提純鎢 |
查看答案和解析>>
科目: 來源:不詳 題型:單選題
 CH3OH(g),其他條件不變,在300℃和500℃時,物質的量n(CH3OH)-反應時間t的變化曲線如圖,下列說法正確的是
CH3OH(g),其他條件不變,在300℃和500℃時,物質的量n(CH3OH)-反應時間t的變化曲線如圖,下列說法正確的是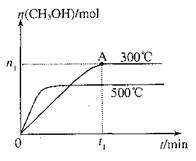
| A.該反應的△H<0 |
| B.其他條件不變,升高溫度反應的平衡常數增大 |
C.300℃時,0–t1 min內CH3OH的平均生成速率為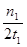 mol?L-1 min-1 mol?L-1 min-1 |
D.A點的反應體系從300℃升高到500℃,達到平衡時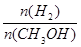 減小 減小 |
查看答案和解析>>
科目: 來源:不詳 題型:單選題

| A.該反應的△H>0 |
| B.在提純過程中,S2的量不斷增加 |
| C.該反應的平衡常數與I2的濃度成正比 |
| D.經過足夠長時間后,石英管右端將得到純凈的TaS2 |
查看答案和解析>>
科目: 來源:不詳 題型:計算題
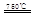 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg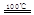 HgBr2+H2
HgBr2+H2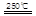 _____ + ④2HgO
_____ + ④2HgO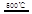 2Hg+O2↑
2Hg+O2↑ CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
查看答案和解析>>
科目: 來源:不詳 題型:計算題
 CO2(g)+H2(g),得到如下三組數據:
CO2(g)+H2(g),得到如下三組數據:| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 (4)尋找新能源是解決溫室效應的一條重要思路。磷酸亞鐵鋰LiFePO4是一種新型汽車鋰離子電池,總反應為:FePO4+Li LiFePO4,電池中的固體電解質可傳導Li+,則該電池放電時的正極和負極反應式分別為: 和 。若用該電池電解蒸餾水(電解池電極均為惰性電極),當電解池兩極共有3360mL氣體(標準狀況)產生時,該電池消耗鋰的質量為 。(Li的相對原子質量約為7.0)
(4)尋找新能源是解決溫室效應的一條重要思路。磷酸亞鐵鋰LiFePO4是一種新型汽車鋰離子電池,總反應為:FePO4+Li LiFePO4,電池中的固體電解質可傳導Li+,則該電池放電時的正極和負極反應式分別為: 和 。若用該電池電解蒸餾水(電解池電極均為惰性電極),當電解池兩極共有3360mL氣體(標準狀況)產生時,該電池消耗鋰的質量為 。(Li的相對原子質量約為7.0)查看答案和解析>>
科目: 來源:不詳 題型:單選題
 pC(g)+qD(g) ΔH<0。下列結論中錯誤的是
pC(g)+qD(g) ΔH<0。下列結論中錯誤的是查看答案和解析>>
科目: 來源:不詳 題型:計算題
 E(g)
E(g)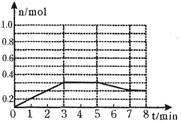
查看答案和解析>>
科目: 來源:不詳 題型:計算題
 N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。該反應可用于消除氮氧化物的污染。在130℃和180℃時,分別將0.50 molCH4和a molNO2充入1L的密閉容器中發生反應,測得有關數據如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。該反應可用于消除氮氧化物的污染。在130℃和180℃時,分別將0.50 molCH4和a molNO2充入1L的密閉容器中發生反應,測得有關數據如下表:| 實驗編號 | 溫度 | 時間 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
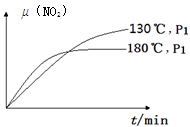
 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2查看答案和解析>>
科目: 來源:不詳 題型:計算題
 2NO(g),生成的NO是汽車尾氣的主要污染物。T ℃時,向5L密閉容器中充入6.5 molN2和7.5 molO2,在5 min時反應達到平衡狀態,此時容器中NO的物質的量是5 mol(不考慮后續反應)。則:
2NO(g),生成的NO是汽車尾氣的主要污染物。T ℃時,向5L密閉容器中充入6.5 molN2和7.5 molO2,在5 min時反應達到平衡狀態,此時容器中NO的物質的量是5 mol(不考慮后續反應)。則:
 2CO2(g) + N2(g) 中,NO的濃度[c(NO)]隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線。
2CO2(g) + N2(g) 中,NO的濃度[c(NO)]隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線。
查看答案和解析>>
科目: 來源:不詳 題型:計算題
 CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g)
CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g) CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。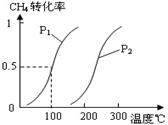
| A.升高溫度 | B.將CH3OH(g)從體系中分離 |
| C.充入He,使體系總壓強增大 | D.再充入1mol CO和3mol H2 |
| 實驗編號 | T(℃) | n(CO)/n(H2) | P(Mpa) |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |
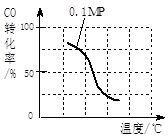
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com