
科目: 來源:不詳 題型:實驗題
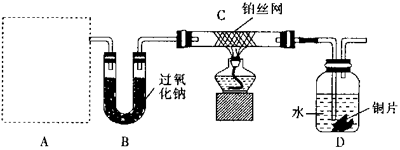
查看答案和解析>>
科目: 來源:不詳 題型:填空題
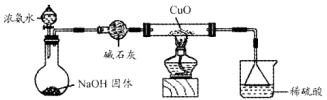
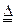 N2+3Cu+3H2O。
N2+3Cu+3H2O。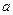 mol氣體后,燒杯中的溶液能使酚酞變紅。試依據“化學實驗設計基本要求”設計制備硫酸亞鐵銨溶液的方案,清簡述實驗方法。
mol氣體后,燒杯中的溶液能使酚酞變紅。試依據“化學實驗設計基本要求”設計制備硫酸亞鐵銨溶液的方案,清簡述實驗方法。 查看答案和解析>>
科目: 來源:不詳 題型:填空題

查看答案和解析>>
科目: 來源:不詳 題型:實驗題
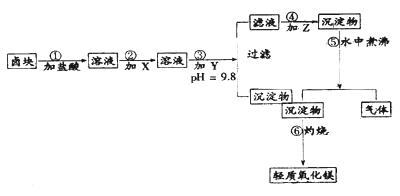
| 物質 | 開始沉淀 | 沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 | 2.7 7.6 8.3 9.6 | 3.7 9.6 9.8 11.1 |
| 試劑 | 價格(元/t) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 鹵塊(MgCl2,30%) | 450 2400 2100 600 310 |
查看答案和解析>>
科目: 來源:不詳 題型:實驗題
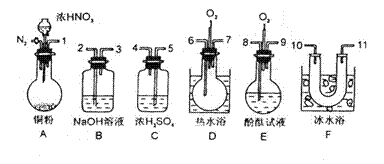 |
查看答案和解析>>
科目: 來源:不詳 題型:實驗題

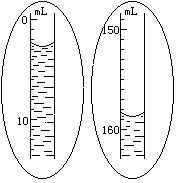
| 鎂條的質量 | w= | | g |
| 氫氣的物質的量 | n= | | mol |
| 反應前量氣管A內讀數 | V1= | | ml |
| 反應后量氣管A內讀數 | V2= | | ml |
| 氫氣的體積 | V | | ml |
| 室溫 | T | | K |
| 大氣壓 | P | | Pa |
查看答案和解析>>
科目: 來源:不詳 題型:實驗題
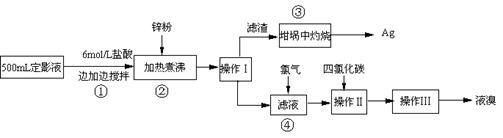

查看答案和解析>>
科目: 來源:不詳 題型:實驗題
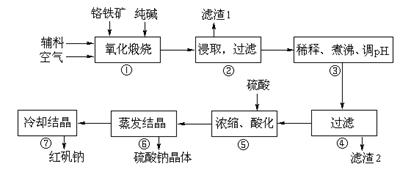
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀時溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
查看答案和解析>>
科目: 來源:不詳 題型:填空題
 +6HCHO=3H++6H2O+(CH2)6N4H+ [滴定時,1 mol(CH2)6N4H+與 l mol H+相當],然后用NaOH標準溶液滴定反應生成的酸,某興趣小組用甲醛法進行了如下實驗:
+6HCHO=3H++6H2O+(CH2)6N4H+ [滴定時,1 mol(CH2)6N4H+與 l mol H+相當],然后用NaOH標準溶液滴定反應生成的酸,某興趣小組用甲醛法進行了如下實驗:
查看答案和解析>>
科目: 來源:不詳 題型:填空題
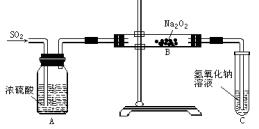

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com