
| 6.3×10-36 |
| 1×10-5 |
| ||
| ||


科目:高中化學 來源: 題型:


 Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O查看答案和解析>>
科目:高中化學 來源: 題型:
(12分)MnSO4·H2O在工業、農業等方面有廣泛的應用。
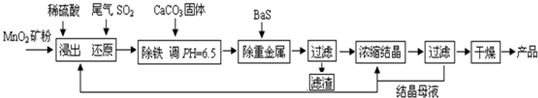
(一)制備:工業上用化工廠尾氣中低濃度SO2還原MnO2礦制備MnSO4·H2O過程如下:
已知: 常溫時部分硫化物難溶鹽的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、MnS--2.5×10-10,請回答下列問題:
(1)生產中MnO2礦粉碎的目的是 。(2)除鐵發生的離子反應方程式為 。
(3)除重金屬離子后,若混合溶液中Cu2+、Pb2+、Ni2+的濃度均為1.0×10-5mol/L,則c(S2-)最大= mol/L。
(二):性質—熱穩定性:MnSO4·H2O在1150℃高溫下分解的產物是Mn3O4、含硫化合物、水,在該條件下硫酸錳晶體分解反應的化學方程式是
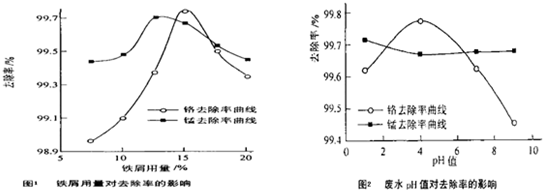
(三)廢水處理:工廠廢水中主要污染為Mn2+和Cr6+,現研究鐵屑用量和pH值對廢水中鉻、錳去除率的影響,(1)取100mL廢水于250mL三角瓶中,調節pH值到規定值,分別加入不同量的廢鐵屑.得到鐵屑用量對鉻和錳去除率的影響如下圖1所示。則在pH一定時,廢水中鐵屑用量為 時錳、鉻去除率最好
(2)取100mL廢水于250 mL三角瓶中,加入規定量的鐵粉,調成不同的pH值。得到pH值對鉻和錳去除率的影響如下圖2所示。則在鐵屑用量一定時,廢水pH= 時錳、鉻去除率最好
查看答案和解析>>
科目:高中化學 來源:2012屆江蘇省揚州中學高三元月雙周練習化學試卷 題型:填空題
(12分)MnSO4·H2O在工業、農業等方面有廣泛的應用。
(一)制備:工業上用化工廠尾氣中低濃度SO2還原MnO2礦制備MnSO4·H2O過程如下: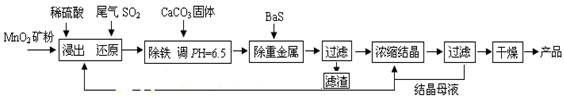
已知:常溫時部分硫化物難溶鹽的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、MnS--2.5×10-10,請回答下列問題:
(1)生產中MnO2礦粉碎的目的是 。(2)除鐵發生的離子反應方程式為 。
(3)除重金屬離子后,若混合溶液中Cu2+、Pb2+、Ni2+的濃度均為1.0×10-5mol/L,則c(S2-)最大= mol/L。
(二):性質—熱穩定性:MnSO4·H2O在1150℃高溫下分解的產物是Mn3O4、含硫化合物、水,在該條件下硫酸錳晶體分解反應的化學方程式是
(三)廢水處理:工廠廢水中主要污染為Mn2+和Cr6+,現研究鐵屑用量和pH值對廢水中鉻、錳去除率的影響,(1)取100mL廢水于250 mL三角瓶中,調節pH值到規定值,分別加入不同量的廢鐵屑.得到鐵屑用量對鉻和錳去除率的影響如下圖1所示。則在pH一定時,廢水中鐵屑用量為 時錳、鉻去除率最好
(2)取100mL廢水于250 mL三角瓶中,加入規定量的鐵粉,調成不同的pH值。得到pH值對鉻和錳去除率的影響如下圖2所示。則在鐵屑用量一定時,廢水pH= 時錳、鉻去除率最好
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三12月階段性測試化學試卷(解析版) 題型:填空題
MnSO4·H2O在工業、農業等方面有廣泛的應用。工業上用化工廠尾氣中低濃度SO2還原MnO2礦制備MnSO4·H2O過程如下:
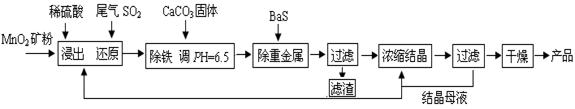
已知: 常溫時部分硫化物難溶鹽的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、
MnS--2.5×10-10,請回答下列問題:
(1)生產中MnO2礦粉碎的目的是 。
(2)除鐵發生的離子反應方程式為 。
(3)除重金屬離子后,若混合溶液中Cu2+、Pb2+、Ni2+的濃度均為1.0×10-5mol/L,則c(S2-)最大= mol/L。
(4)已知MnSO4·H2O在1150℃高溫下分解的產物是Mn3O4、含硫化合物、水,則在該條件下硫酸錳晶體分解反應的化學方程式是
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com