
【題目】同溫同壓下相同體積的兩種氣體12C18O和14N2,下列判斷正確的是( )
A.分子數目相等B.中子數相等
C.密度之比為14:15D.電子數之比為2:3
【答案】A
【解析】
A.同溫同壓下,其體積之比=物質的量之比=分子個數之比,相同體積的兩種氣體12C18O和14N2含有相同的分子數,故A正確;
B.每個12C18O和14N2分子中中子數分別是16、14,相同體積的兩種氣體12C18O和14N2含有相同的分子數,因為其分子中中子數之比為8:7,所以其總中子數不等,故B錯誤;
C.同溫同壓下,氣體摩爾體積相等,兩種氣體12C18O和14N2的摩爾質量分別是30 g/mol、28g/mol,根據![]() 知,其密度之比等于摩爾質量之比,二者的摩爾質量之比為15:14,所以其密度之比為15:14,故C錯誤;
知,其密度之比等于摩爾質量之比,二者的摩爾質量之比為15:14,所以其密度之比為15:14,故C錯誤;
D.同溫同壓下,其體積之比=物質的量之比=分子個數之比,每個12C18O和14N2分子中電子數都是14個,所以二者的電子數相等,故D錯誤;
答案選A。


科目:高中化學 來源: 題型:
【題目】三支體積相等的試管分別充滿相同狀態下氣體:①氨氣;②體積比為4:l的NO2和O2氣體;③NO2氣體;將他們分別倒立于盛有足量水的水槽中,液面恒定后(假設試管內液體不擴散),則下列結論正確的是( )
A.①和③試管內溶液體積不等,溶質物質的量濃度也不相等
B.因為它們都可溶于水,所以液面都上升到試管頂部
C.三支試管中,試管②中溶液中溶質的物質的量濃度最小
D.試管②和試管③中溶液的溶質的物質的量濃度一定相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前很多工廠實現了煙氣的脫硫脫硝和氨氮廢水的無害化處理,回答下列問題:
(1)某小組同學在實驗室里嘗試模擬工廠處理氨氮廢水(主要含NH![]() )的不同方法,過程如下:①甲同學采用Ca(ClO)2作為氧化劑。將廢水中的NH
)的不同方法,過程如下:①甲同學采用Ca(ClO)2作為氧化劑。將廢水中的NH![]() 轉化為無毒氣體。他在實驗中發現其他條件相同時,Ca(ClO)2的濃度越大堿性越強,處理后的廢水中亞硝酸鹽(NO
轉化為無毒氣體。他在實驗中發現其他條件相同時,Ca(ClO)2的濃度越大堿性越強,處理后的廢水中亞硝酸鹽(NO![]() )的濃度也隨之變大,寫出該反應的離子方程式:___。
)的濃度也隨之變大,寫出該反應的離子方程式:___。
②乙同學在實驗室模擬工業上的“吹脫法”測定廢水的含氮量,設計了以下實驗:精確稱取wg廢水樣品,注入如所圖示的儀器中,然后逐滴加入足量10%NaOH溶液,通入水蒸氣。將樣品液中的氨全部蒸出,用V1mLc1mol·L-1鹽酸標準溶液吸收。蒸氨結束后取下接收瓶,用c2molL-1NaOH標準溶液滴定過剩的HCl,到終點時消耗V2mLNaOH溶液。
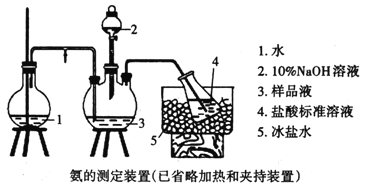
NH4Cl的電子式為___。盛放樣品液的儀器是___(填名稱);圓底燒瓶中長玻璃導管的作用是___;冰鹽水的作用是___。
(2)某工廠利用NaClO2/(NH4)2CO3溶液脫除煙氣中的SO2和NO。①保持溶液中NaClO2的濃度不變,研究(NH4)2CO3的濃度對NO和SO2脫除效率的影響[已知:(NH4)2CO3溶液顯堿性;NaClO2的氧化性隨pH增加而下降,酸性條件下會生成ClO2]。實驗結果如圖所示,隨著(NH4)2CO3溶液濃度的增大造成NO脫除效率下降的主要原因是___。
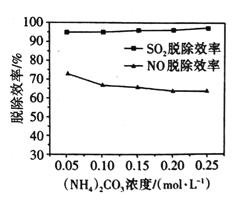
②NO脫除效率總是小于SO2脫除效率的主要原因是___。(寫出一點)
(3)某工廠采用微生物硝化法處理氨氮廢水,過程如圖:
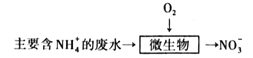
下列有關說法正確的是___(填標號)。
①微生物硝化法處理廢水后會導致水體的pH升高
②若微生物保持活性的pH范圍為7~9,則適宜用來調節水體pH的是CO2
③不能采用電解法在陰極將NH![]() 直接轉化為NO
直接轉化為NO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,向一密閉容器中充入一定量的NH3,反應2NH3(g)![]() N2(g)+3H2(g)達到平衡時N2的體積分數與溫度、壓強的關系如圖所示。下列說法正確的是
N2(g)+3H2(g)達到平衡時N2的體積分數與溫度、壓強的關系如圖所示。下列說法正確的是

A. 壓強:p1>p2
B. b、c兩點對應的平衡常數:Kc>Kb
C. a點:2v(NH3)正=3v(H2)逆
D. a點:NH3的轉化率為1/3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列變化一定屬于化學變化的是( )
①金屬導電 ②燃燒 ③煤的干餾 ④焰色反應 ⑤無水硫酸銅吸水 ⑥工業制氧氣 ⑦白磷轉變成紅磷 ⑧久置濃硝酸變黃 ⑨丁達爾現象 ⑩煤旳液化
A.①④⑨B.⑥⑧⑩C.②⑥⑦D.②③⑤⑦⑧⑩
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子一定能大量共存的是( )
A.使pH試紙顯深藍色的溶液中:S2-、NO![]() 、Br-、SO
、Br-、SO![]()
B.與鋁粉反應放出H2的無色溶液中:Cl-、Al3+、Na+、SO![]()
C.氯化鈉溶液中:Ag+、NH![]() 、Ca2+、ClO-
、Ca2+、ClO-
D.稀硫酸溶液中:Fe2+、NO![]() 、Na+、K+
、Na+、K+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中離子在水溶液中能大量共存且滿足相應要求的是( )
選項 | 離子 | 要求 |
A | K+、NO | c(K+)<c(Cl-) |
B | Na+、NO | 逐滴滴加鹽酸立即有氣體產生 |
C | Na+、Al3+、Mg2+、SO | 逐滴滴加氨水立即有沉淀產生 |
D | NH | 滴加NaOH濃溶液立刻有氣體產生 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種利用H2C2O4(草酸)作助溶劑,酸浸提取硫酸燒渣(主要含Fe2O3、FeO、SiO2等)制備鐵紅并回收副產物硫酸銨的工藝流程如圖:
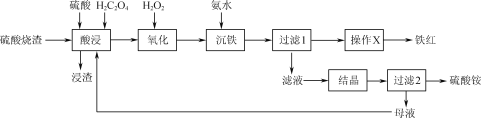
已知:H2C2O4可沉淀Ca2+、Fe2+等金屬離子,可與Fe3+生成[Fe(C2O4)3]3-,在硫酸作用下可熱分解生成CO和CO2。
(1)用50%的硫酸“酸浸”時,反應液的溫度、H2C2O4的加入量對鐵浸取率的影響分別如圖1、圖2所示:
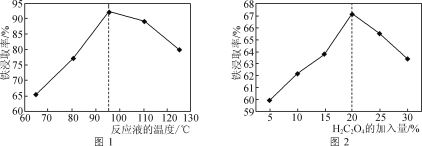
①“硫酸燒渣”中Fe2O3與H2SO4反應的化學方程式為___。
②圖1中,反應液的溫度高于95℃時,鐵浸取率開始降低,其原因是___。
③圖2中,H2C2O4加入量在5~20%時,鐵浸取率隨加入量的增大而增大,其原因是__;H2C2O4加入量超過20%時,鐵浸取率反而開始降低,其原因是___。
(2)“沉鐵”時發生的主要反應的離子方程式為____。
(3)由“過濾1”的濾渣制備鐵紅的“操作X”為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知由金屬鈉制得氧化鈉,可用多種方法:a.4Na+O2===2Na2O,b.4Na+CO2===2Na2O+C,c.2NaNO2+6Na===4Na2O+N2↑。
①在上述三種方法中,最好的方法是________(填序號),原因是________________。
②上述反應c中NaNO2作________劑,當有1 mol NaNO2反應時,電子轉移的數目是________________________________________________________________________。
(2)現用金屬鈉和空氣制備純度較高的Na2O2,可利用的裝置如下。回答下列問題(注:Na2O2可以與H2O、CO2反應):
①裝置Ⅳ中盛放的藥品是________,其作用是____________________________。


②若規定氣體的氣流方向從左到右,則組合實驗裝置時各儀器接口的標號字母(a、b……)順序:空氣進入________,________接________,________接________,________接________。
③裝置Ⅱ的作用____________________________________________________。
④操作中通空氣和加熱的順序為________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com