
| A. | 常溫下,c(H+)=10-13mol•L-1的溶液中:Na+、AlO2-、S2-、SO32- | |
| B. | 使pH試紙呈紅色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 加入鋁粉有氫氣生成的溶液中:Mg2+、Cu2+、SO42-、K+ | |
| D. | 常溫下,由水電離出的c(H+)•c(OH-)=1.0×10-26的溶液中:K+、Na+、HCO3-、Ca2+ |
分析 A.常溫下,c(H+)=10-13mol•L-1的溶液,顯堿性;
B.使pH試紙呈紅色的溶液,顯酸性;
C.加入鋁粉有氫氣生成的溶液,為非氧化性酸或強堿溶液;
D.常溫下,由水電離出的c(H+)•c(OH-)=1.0×10-26的溶液,為酸或堿溶液.
解答 解:A.常溫下,c(H+)=10-13mol•L-1的溶液,顯堿性,該組離子之間不反應,可大量共存,故A選;
B.使pH試紙呈紅色的溶液,顯酸性,Fe2+、I-均與NO3-發生氧化還原反應,不能共存,故B不選;
C.加入鋁粉有氫氣生成的溶液,為非氧化性酸或強堿溶液,堿溶液中不能大量存在Mg2+、Cu2+,故C不選;
D.常溫下,由水電離出的c(H+)•c(OH-)=1.0×10-26的溶液,為酸或堿溶液,酸堿溶液中不能大量存在HCO3-,故D不選;
故選A.
點評 本題考查離子共存,為高頻考點,把握習題中的信息及離子之間的反應為解答的關鍵,側重分析與應用能力的考查,注意復分解反應、氧化還原反應的判斷,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
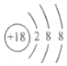

| A. | 1個 | B. | 2個 | C. | 3個 | D. | 4個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
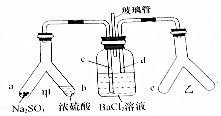 Y形管是一種特殊的儀器,與其他儀器組合可以進行某些實驗探究.利用如圖裝置可以探究SO2與BaCl2反應生成BaSO3沉淀的條件,下列判斷正確的( )
Y形管是一種特殊的儀器,與其他儀器組合可以進行某些實驗探究.利用如圖裝置可以探究SO2與BaCl2反應生成BaSO3沉淀的條件,下列判斷正確的( )| A. | 玻璃管的作用是連通大氣,使空氣中的氧氣進人廣口瓶,參與反應 | |
| B. | c、d兩根導管郡必須插人BaCl2溶液中,保證氣體與Ba2+充分接觸 | |
| C. | Y形管乙中產生的為氧化性氣體,將BaSO3氧化為BaSO4沉淀 | |
| D. | e、f兩管中的試劑可以分別是濃氨水和NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHSO3 | B. | NaOH和Na2SO3 | C. | Na2SO3 | D. | Na2SO3和NaHSO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
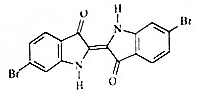 地中海沿岸出產的一種貴重染料經化學分析,其主要組成的結構如圖所示,下列說法不正確的是( )
地中海沿岸出產的一種貴重染料經化學分析,其主要組成的結構如圖所示,下列說法不正確的是( )| A. | 屬于烴的衍生物 | |
| B. | 分子式為C16H8O2N2Br2 | |
| C. | 1mol該有機物與H2加成最多消耗9molH2 | |
| D. | 該有機物溴元素檢驗可將有機物與堿液共熱后,直接加入硝酸銀溶液,觀察是否有淺黃色沉淀生成. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 離子種類 | 開始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
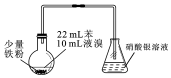
| A. | 制備溴苯的反應屬于取代反應 | |
| B. | 燒瓶中反應發生后,有白霧產生,繼而充滿紅棕色氣體 | |
| C. | 實驗加入試劑的順序可以是:苯、液溴、鐵粉 | |
| D. | 為了增強驗證HBr的實驗效果,可將錐形瓶中的導管插入溶液中 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com