

分析 無隔膜電解槽中持續電解飽和氯化鈉溶液,則電解生成的氯氣和氫氧化鈉反應生成氯酸鈉溶液,通二氧化硫和X酸還原氯酸鈉溶液生成二氧化氯,再用雙氧水、氫氧化鈉吸收反應生成亞氯酸鈉,過濾的亞氯酸鈉(NaClO2)溶液通過蒸發結晶得到亞氯酸鈉晶體.
(1)根據電解池中陽極失去電子結合產物書寫;
(2)由于ClO2氣體在中性和堿性溶液中不能穩定存在,所以只能在酸性環境中存在.由于在酸性條件下,氯酸鈉容易和鹽酸發生氧化還原反應,所以X應該是硫酸;H2O2不穩定,溫度過高,H2O2容易分解,吸收塔的溫度不能過高,其目的是防止H2O2分解.
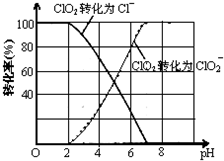
(3)根據圖象可知,pH≤2時ClO2被還原為Cl-,所以該反應的離子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O.
(4)根據ClO2將CN-氧化,生成了兩種無毒無害的氣體即二氧化碳和氮氣來書寫方程式并計算.
解答 解:(1)電解池中陽極失去電子,所以溶液中的氯離子在陽極失去電子,因此反應的電極反應式是Cl--6e-+6OH-=ClO3-+3H2O,故答案為:Cl--6e-+6OH-=ClO3-+3H2O;
(2)由于ClO2氣體在中性和堿性溶液中不能穩定存在,所以只能在酸性環境中存在.由于在酸性條件下,氯酸鈉容易和鹽酸發生氧化還原反應,所以X應該是硫酸;H2O2不穩定,溫度過高,H2O2容易分解,吸收塔的溫度不能過高,其目的是防止H2O2分解;
故答選:B;溫度過高H2O2將分解;
(3)根據圖象可知,pH≤2時ClO2被還原為Cl-,所以該反應的離子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O;
故答案為:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O;
(4)ClO2將CN-氧化,生成了兩種無毒無害的氣體即二氧化碳和氮氣,所以離子方程式為:2ClO2+2CN-=2Cl-+2CO2+N2↑;根據方程式1molCN-離子消耗1mol二氧化氯,所以處理100m3這種污水,至少需要ClO2為$\frac{100×10{\;}^{3}×a×1{0}^{-3}}{26}$mol=$\frac{100a}{26}$mol,故答案為:2ClO2+2CN-=2Cl-+2CO2+N2↑;$\frac{100a}{26}$.
點評 本題以學生比較陌生的亞氯酸鈉制備為背景,以過氧化氫法制備亞氯酸鈉為主線,考查學生閱讀題目獲取信息的能力、對濃度概念的理解、對氧化還原反應相關知識的運用、有關實驗操作和簡單實驗設計能力考察以及在新情境下綜合運用知識解決問題的能力,題目有一定的難度.


科目:高中化學 來源: 題型:解答題
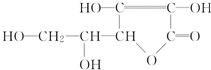 維生素C的結構簡式如圖所示:
維生素C的結構簡式如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 振蕩分液漏斗時應關閉其玻璃塞和活塞 | |
| B. | 用濕潤的碘化鉀淀粉試紙鑒別Br2(g)和NO2 | |
| C. | 在50mL量筒中配制0.1000mol•L-1碳酸鈉溶液 | |
| D. | 檢驗NH4+時,向試樣中加入NaOH溶液,微熱,用濕潤的藍色石蕊試紙檢驗逸出的氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
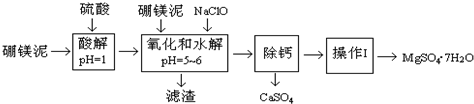
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 開始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 溫度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | 性質(沸點及分解溫度均為101kPa測得) |
| 鄰苯二甲酸酐 (M=148g/mol) | 白色針狀晶體.不溶于冷水,溶于熱水及有機溶劑. 密度1.53g/cm3,沸點295℃. |
| 正丁醇(M=74g/mol) | 無色液體.微溶于水,溶于有機溶劑.密度0.81g/cm3,沸點117.7℃.可與水形成二元共沸物(沸點92.7℃). |
| 鄰苯二甲酸二丁酯 (M=278g/mol) | 無色油狀液體.難溶于水,溶于有機溶劑.密度1.49g/cm3,沸點340℃.酸性條件下180℃以上易發生分解. |
 轉變成鹽,從而與產物分離,該操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氫氧化鈉堿性太強,能使鄰苯二甲酸二丁酯發生水解;.加入食鹽水洗滌一方面是防止有機物發生乳化而不利于分層,另一方面是為了降低鄰苯二甲酸二丁酯的溶解度.
轉變成鹽,從而與產物分離,該操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氫氧化鈉堿性太強,能使鄰苯二甲酸二丁酯發生水解;.加入食鹽水洗滌一方面是防止有機物發生乳化而不利于分層,另一方面是為了降低鄰苯二甲酸二丁酯的溶解度.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 氫氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.2g銅與足量稀硝酸反應過程中轉移電子0.1NA | |
| B. | 35.5g超氧化鉀(KO2)所含的陰離子的數目為NA | |
| C. | 標準狀況下將0.5molSO2氣體與0.5molH2S氣體混合后,氣體的分子總數為NA | |
| D. | 6g二氧化硅中含Si-O鍵數為0.2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com