
人們應用原電池原理制作了多種電池以滿足不同的需要。在現(xiàn)代生活、生產(chǎn)和科學技術(shù)發(fā)展中,電池發(fā)揮著越來越重要的作用,如在宇宙飛船、人造衛(wèi)星、空間電視轉(zhuǎn)播站、飛機、輪船、電腦、收音機、照相機、電子手表、心臟起搏器等,都離不開各式各樣的電池,同時廢棄的電池隨便丟棄也會對環(huán)境造成污染。請根據(jù)題中提供的信息,回答下列問題:
(1)電子表和電子計算器中所用的是紐扣式微型銀鋅電池,其電極分別為Ag2O和Zn,電解質(zhì)為KOH溶液,工作時電池總反應為Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作時電流從________極流向________極(填“Ag2O”或“Zn”)。
②電極反應式:正極______________________________________________,
負極:_______________________________________________________________。
③工作時電池正極區(qū)的pH________(填“增大”、“減小”或“不變”)。
(2)氫鎳電池是近年來開發(fā)出來的可充電電池,它可以取代會產(chǎn)生鎘污染的鎘鎳電池。氫鎳電池的總反應式是1/2H2+NiO(OH) 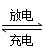 Ni(OH)2。
Ni(OH)2。
電池放電時,負極是____________,負極的電極反應式為_________,正極的電極反應式為___________,正極附近溶液的pH如何變化?______________。
(1)①Ag2O Zn
②Ag2O+2e-+H2O===2Ag+2OH- Zn-2e-+2OH-===Zn(OH)2 ③增大
(2)H2 1/2H2-e-+OH-===H2O NiO(OH)+e-+H2O===Ni(OH)2+OH- 增大
【解析】考查原電池的有關(guān)判斷及計算。
(1)在原電池中負極失去電子,經(jīng)導線傳遞到正極上。根據(jù)反應式可知鋅為負極,氧化銀為正極,所以電子從鋅極流向氧化銀極。由于鋅上活潑的金屬,所以電解質(zhì)溶液不能是酸性溶液,而是堿性溶液,即為氫氧化鉀。
正極電極反應式為:Ag2O+H2O+2e-=2Ag+2OH-
負極電極反應式為:Zn-2e-+2OH-===Zn(OH)2
根據(jù)總反應式可知,反應后生成了氫氧化鋅,所以溶液的堿性是增強的,即pH是增大的。
(2)。放電相當于原電池,充電相當于電解池。根據(jù)總反應式可知,放電時,負極氫氣失去電子,電極反應式是H2-2e-+2OH-=2H2O,所以負極周圍溶液的pH降低;正極NiO(OH)得電子,電極反應式是NiO(OH)+e-+H2O===Ni(OH)2+OH-,有OH—的生成,所以正極周圍溶液的pH升高


科目:高中化學 來源:高一化學 專題4 化學科學與人類文明 4.1 化學是認識和創(chuàng)造物質(zhì)的科學(蘇教版必修2) 蘇教版 題型:022
| |||||||||||||||||||||||||
查看答案和解析>>
科目:高中化學 來源:必修二全優(yōu)指導化學蘇教版 蘇教版 題型:043
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com