
【題目】某中學化學研究性學習小組利用以下裝置制取并探究氨氣的性質.A中發生反應的化學方程式:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
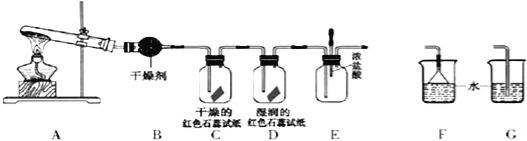
(1)A裝置還可用于制取 氣體(只填一種).
(2)若有10.7gNH4Cl固體,最多可制取NH3(標準狀況)的體積是 L.
(3)實驗室收集氨氣的方法是 .
(4)C、D裝置中顏色會發生變化的是 (填“C”或“D”)
(5)當實驗進行一段時間后,擠壓E裝置中的膠頭滴管,滴入1~2滴濃鹽酸,可觀察到的現象是 .
(6)為防止過量氨氣造成空氣污染,需要在上述裝置的末端增加一個尾氣處理裝置,合適的裝置是 (填“F”或“G”).
【答案】(1)O2;(2)4.48(3)向下排空氣法(4)D(5)有白煙生成(6)F
【解析】解:(1)該裝置是加熱固體制備氣體的裝置,還可用于制取氧氣,如氯酸鉀在二氧化錳的催化作用下加熱生成氯化鉀和氧氣,反應的化學方程式為:2KClO3![]() 2KCl+3O2↑.
2KCl+3O2↑.
故答案為:O2;
(2)n(NH4Cl)═=![]() =0.2mol,根據反應方程式2NH4Cl+Ca(OH)2
=0.2mol,根據反應方程式2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O可知,n(NH3)=n(NH4Cl)=0.2mol,所以V(NH3)=nVm=0.2mol×22.4L/mol=4.48L,
CaCl2+2NH3↑+2H2O可知,n(NH3)=n(NH4Cl)=0.2mol,所以V(NH3)=nVm=0.2mol×22.4L/mol=4.48L,
故答案為:4.48;
(3)氨氣易溶于水,不能用排水法收集,氨氣密度比空氣小,所以用向下排空氣法收集,
故答案為:向下排空氣法;
(4)氨氣與干燥的紅色石蕊試紙不變色,氨氣遇水生成一水合氨,電離出的氫氧根離子能使紅色石蕊試紙變藍,所以氨氣能使濕潤的紅色石蕊試紙變藍,所以D中顏色發生變化,
故答案為:D;
(5)氨氣和氯化氫反應生成固體氯化銨,將兩支分別蘸取濃氨水和濃鹽酸的玻璃棒靠近,濃氨水揮發出的氨氣和濃鹽酸揮發出的氯化氫相遇反應,可以觀察到玻璃棒之間出現大量白煙;
故答案為:有白煙生成;
(6)因為氨氣極易溶于水,所以吸收氨氣時要用防倒吸裝置,F倒扣的漏斗具有球形部分起緩沖作用,能防止倒吸,
故答案為:F.


科目:高中化學 來源: 題型:
【題目】若要使0.5mol甲烷和Cl2發生取代反應,反應后CH4與Cl2均無剩余,并生成的四種取代產物的物質的量依次增加0.05mol,則需要Cl2的物質的量為( )
A.1.75mol B.2mol C.1.25mol D.1.5mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據所學知識,請回答下列問題:
(1)用離子方程式表示除去鐵粉中混有的鋁粉 。
(2)檢測Fe2(SO4)3溶液中是否含有少量的FeSO4的操作方法是__________________。
(3)用H2O2和稀H2SO4的混合溶液可溶出印刷電路板金屬粉末中的銅,請寫出表示該過程的離子方程式 。
(4)工業制備粗硅的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法或推理正確的是
A. 將Fe(N03)2樣品溶于稀H2SO4后,滴加KSCN溶液,溶液變紅,則Fe(N03)2晶體已氧化變質
B. 常溫下,pH都為11的氫氧化鈉溶液和氨水均加水稀釋100倍,pH都變為9
C. 25℃時,Ksp(BaCO3)>Ksp(BaCrO4),則沉淀水體中的Ba2+選擇Na2CrO4比Na2CO3好
D. 將CH3CH2Br與NaOH溶液共熱,冷卻后取出上層溶液,加入AgNO3溶液,產生沉淀,則CH3CH2Br在NaOH溶液中發生了水解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(10分)醇酸樹脂容易固化成膜,成膜后有光澤和韌性,附著力強,井具有良好的耐磨性和絕緣性等性能,下面是一種醇酸樹脂M的合成路線:

已知:①有機物C的核磁共振氫譜顯示只有兩種不同化學環境的氫
②
按要求回答問題:
(1)F中官能團的名稱為_______,已知條件中②的反應類型為_______
(2)B的結構簡式為_______。
(3)寫出C+F→M的化學方程式:_______。
(4)符合下列條件的 同分異構體有______種。
同分異構體有______種。
A.能與濃溴水反應產生白色沉淀,且1mol該物質可消耗2molBr2
b.能發生消去反應
(5)設計以甲醛和丙醛為原料制備![]() 的合成路線(用流程圖表示,無機試劑任選)注:合成路線的書寫格式參照如下實例:
的合成路線(用流程圖表示,無機試劑任選)注:合成路線的書寫格式參照如下實例:
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知銅與稀硝酸反應的化學方程式為:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O現將9.60g的銅單質加入到過量的8.40%的稀硝酸中,充分反應后,試求:
(1)標準狀況下生成NO多少L?
(2)這些銅單質能與多少g上述稀硝酸恰好完全反應?
(3)反應中有多少molHNO3被還原?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如表是元素周期表的一部分,按要求填空( 填元素符號或化學式):
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)寫出①元素的元素名稱 .
(2)寫出⑩元素的元素符號 .
(3)⑨在元素周期表中的位置:第 周期,第 族.
(4)在這些元素中, 是最活潑的金屬元素; 是最活潑的非金屬元素; 是最不活潑的元素.(用元素符號填寫)
(5)能形成氣態氫化物,且氣態氫化物最穩定的是 .(用化學式填寫)
(6)這些元素的最高價氧化物對應水化物中最強的酸是 ;最強的堿是 ;具有兩性的氫氧化物是 .(用化學式填寫)
(7)從⑤到的元素中, 原子半徑最小.(用元素符號填寫)
(8)比較⑤與⑥的化學性質, 更活潑(用元素符號填寫),試用實驗證明此現象(簡述實驗操作、現象和結論) .
(9)用電子式表示元素④與⑥形成的化合物: ,該化合物屬于 (填“共價”或“離子”)化合物.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】雯雯在自學碳酸鈉性質時,查到了以下資料:
① CO2+ Na2CO3+ H2O === 2NaHCO3,CO2通入飽和碳酸鈉溶液會產生白色沉淀,CO2不溶于飽和碳酸氫鈉溶液。
② 碳酸鈉、碳酸氫鈉在不同溫度下的溶解度
0℃ | 10℃ | 20℃ | 30℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【進行實驗1】驗證CO2通入飽和碳酸鈉溶液會產生白色沉淀
① 配制碳酸鈉溶液:取100 g 20℃的水,加入35 g碳酸鈉固體,攪拌后,靜置,取上層清液。
② 利用裝置一進行實驗,連續5分鐘向新制得的碳酸鈉溶液中通入CO2。

【發現問題】實驗中,始終沒有看到沉淀現象,原因是什么呢?雯雯進行了以下實驗探究。
【進行實驗2】
實驗操作 | 實驗現象 |
① 取100 g 20℃的水,加入35 g碳酸鈉固體,攪拌后,靜置,取上層清液 ② 利用裝置二進行實驗,連續5分鐘向新制得的碳酸鈉溶液中通入CO2 | 沒有出現白色沉淀 |
(1)在0℃~30℃,Na2CO3和NaHCO3的溶解度受溫度變化影響較大的是 。
(2)大理石與稀鹽酸反應的化學方程式為 。
(3)裝置二中飽和碳酸氫鈉溶液的作用是 。
【進行實驗3】
實驗操作 | 實驗現象 |
① 取100 g熱開水,加入35 g碳酸鈉固體,完全溶解,再降溫至20℃,取上層清液 ② 利用裝置一和裝置二分別進行實驗,連續3分鐘向新制得的碳酸鈉溶液中通入CO2 | 裝置一和裝置二中的碳酸鈉溶液中均出現白色沉淀 |
(4)雯雯在最初的實驗中沒有看到沉淀現象的原因是 。
(5)CO2通入飽和碳酸鈉溶液會產生白色沉淀的原因是 。
(6)請你依據題中信息,寫出一種能夠區分碳酸鈉和碳酸氫鈉固體的實驗方案 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com