
【題目】已知在稀溶液中,強酸跟強堿發生中和反應生成1mol水時的反應熱叫做中和熱。現利用如圖裝置進行中和熱的測定,請回答下列問題:
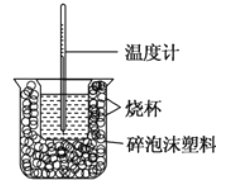
(1)圖中缺少的儀器或用品有______、______。
(2)做一次完整的中和熱測定實驗,溫度計需使用_____次。
(3)把溫度為15.0℃,濃度為0.5mol/L的酸溶液和0.55mol/L的堿溶液各50mL混合(溶液密度均為1g/mL),生成溶液的比熱容c=4.18 J·g-1·℃-1,輕輕攪動,測得酸堿混合液的溫度變化數據如下:
反應物 | 起始溫度t1/℃ | 終止溫度t2/℃ | 中和熱 |
HCl+NaOH | 15.0 | 18.3 | △H1 |
HCl+NH3·H2O | 15.0 | 18.0 | △H2 |
①計算表格中第一組實驗測出的中和熱△H1=______(保留一位小數)。
②寫出表格中第二組實驗的熱化學方程式:_______________(保留一位小數)。
③兩組實驗結果差異的原因是________________。
④堿溶液過量的原因是___________。
【答案】 環形玻璃攪拌棒 燒杯上方的泡沫塑料板或硬紙板 3 -55.2KJ/mol HC1(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(1)△H=-50.2kJ/mol NH3·H2O是弱堿,在中和過程中NH3·H2O發生電離,要吸熱,因而放熱少 使酸完全反應
【解析】(1)根據中和熱的測定裝置及該圖所示可判斷,圖中有兩處未畫出,它們分別是環形玻璃攪拌棒、燒杯上方的泡沫塑料蓋;(2)做一次完整的中和熱測定實驗,溫度計需測量反應前鹽酸、氫氧化鈉溶液的溫度及二者混合反應后溶液的溫度,故至少需使用3次;(3)①反應以不足量的HCl為標準計算,n(HCl)=n(H2O)=0.5mol/L×0.05L=0.025mol,Q=cm△t=4.18J/(g℃)×100g×(18.3-15)℃=1379.4J,則△H1=-1379.4J÷0.025mol=-55176J/mol≈-55.2kJ/mol;②根據以上分析可知第二組實驗中Q=cm△t=4.18J/(g℃)×100g×(18-15)℃=1254J,則△H2=-1254J÷0.025mol=-50160J/mol≈-50.2kJ/mol,所以該反應的熱化學方程式是HCl(aq)+NH3H2O(aq)=NH4Cl(aq)+H2O(l)△H2=-50.2kJ/mol;③反應熱是酸、堿發生中和反應產生1mol水放出的熱量。由于NH3H2O是弱堿,存在電離平衡,電離需要吸收熱量,故反應產生1mol水放出的熱量比強堿NaOH少。④根據以上分析可知堿溶液過量的原因是使酸完全反應。


 優學名師名題系列答案
優學名師名題系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 一定條件下,乙酸乙酯、葡萄糖、蛋白質都能與水發生水解反應
B. 蛋白質溶液中加入飽和硫酸銨溶液,蛋白質發生變性
C. 全降解塑料![]() 可由環氧丙烷
可由環氧丙烷![]() 和CO2縮聚制得
和CO2縮聚制得
D. 植物秸桿的主要成分是纖維素,纖維素在催化劑作用下經水解可得葡萄糖,葡萄糖在酒化酶的作用下能轉化為酒精
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩個容積均為1.12 L的容器,在同溫同壓下,一個盛滿N2,另一個盛滿CO氣體,則兩容器內氣體的關系錯誤的是
A.氣體分子數均為3.01×1022B.密度相等
C.原子數相等D.電子數相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組按如下實驗流程探究海帶中碘的制取。甲、乙兩種實驗方案如下:
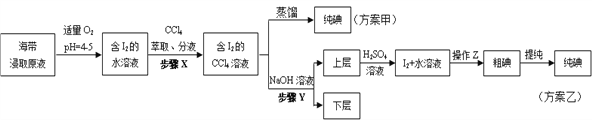
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(1)分液漏斗使用前須檢漏,檢漏方法為_____________
(2)步驟X中,萃取后分液漏斗內觀察到的現象是_____________
(3)下列有關步驟Y的說法,正確的是_____________
A.應控制NaOH溶液的濃度和體積 B.將碘轉化成離子進入水層
C.操作Z的名稱是過濾 D.NaOH溶液可以由乙醇代替
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.1 mol O的質量是 32g/mol
B.OH﹣的摩爾質量是17g
C.1mol H2O的質量是18g/mol
D.CO2的摩爾質量是44g/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將等物質的量的A和B,混合于2L的密閉容器中,發生如下反應:3A(g)+B(g)![]() xC(g)+2D(g),5min后測得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反應速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后測得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反應速率是 0.15 mol/(Lmin)。
(1)B的反應速率v(B)=__________________X=____________
(2)A在5min末的濃度是________________
(3)此時容器內的壓強與開始時之比為:___________。
(4)二氯化硫(S2Cl2)是一種琥珀色液體,是合成硫化染料的重要原料。
a. 寫出它的電子式______________;
b. 指出它分子內的鍵型______________。
c. 指出硫元素的化合價為______________。
(5)硒的原子序數為34,硒的單質及其化合物用途非常廣泛。
a.硒在元素周期表中的位置是___________。Se2Cl2常用作分析試劑,其結構式為_______。
b.硒化銦是一種可應用于未來超算設備的新型半導體材料。已知銦(In)與鋁同族且比鋁多兩個電子層。下列說法正確的是________(填字母)。
A.原子半徑:In>Se B.In的金屬性比Se強
C.In的金屬性比Al弱 D.硒化銦的化學式為InSe2
c.推測SeO2的化學性質(任寫一條即可)_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
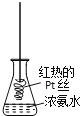
【題目】探究氨氣及銨鹽性質的過程中,下列根據實驗現象得出的結論不正確的是( )
A. 將集有氨氣的試管倒扣于水槽中,液體迅速充滿試管,說明氨氣極易溶于水
B. 將pH=11的氨水稀釋1000倍,測得pH>8,說明NH3·H2O為弱堿
C. 加熱NH4HCO3固體,觀察到固體逐漸減少,試管口有液滴產生,說明NH4HCO3受熱不穩定
D. 將紅熱的Pt絲伸入右圖所示的錐形瓶中,瓶口出現少量紅棕色氣體,說明氨氣的氧化產物為NO2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com