
【題目】在下列物質轉化中,A是一種正鹽,D的相對分子質量比C的相對分子質量大16,E是酸,當X無論是強酸還是強堿時,都有如下的轉化關系:
![]()
當X是強酸時,A、B、C、D、E均含同一種元素;當X是強堿時,A、B、C、D、E都含另外同一種元素。請回答:
(1)A是__________,Y是__________,Z是__________。
(2)當X是強酸時,E是__________;B生成C的化學方程式是________________________。
(3)當X是強堿時,E是__________; B生成C的化學方程式是________________________。
【答案】(NH4)2S O2 H2O H2SO4 2H2S+3O2![]() 2SO2+2H2O HNO3 4NH3+5O2
2SO2+2H2O HNO3 4NH3+5O2 4NO+6H2O
4NO+6H2O
【解析】
本題中C、D的變化和D的相對分子質量比C的大16是題中一個最具有特征的條件,通過分析可初步判斷D比C多一個氧原子,A為(NH4)2S,聯想已構建的中學化學知識網絡,符合這種轉化關系的有:SO2→SO3,NO→NO2,Na2SO3→Na2SO4等,由此可出推斷Y為O2,由于E為酸,則D應為能轉化為酸的某物質,很可能為SO3、NO2等,
當X是強酸時A、B、C、D、E均含同一種元素,則B為H2S,C為SO2,D為SO3,E為H2SO4,Z為H2O,當X是強堿時,則B為NH3,C為NO,D為NO2,E為HNO3,Z為H2O,據此答題。
本題中C、D的變化和D的相對分子質量比C的大16是題中一個最具有特征的條件,通過分析可初步判斷D比C多一個氧原子,A為(NH4)2S,聯想已構建的中學化學知識網絡,符合這種轉化關系的有:SO2→SO3,NO→NO2,Na2SO3→Na2SO4等,由此可出推斷Y為O2,由于E為酸,則D應為能轉化為酸的某物質,很可能為SO3、NO2等,
當X是強酸時A、B、C、D、E均含同一種元素,則B為H2S,C為SO2,D為SO3,E為H2SO4,Z為H2O,當X是強堿時,則B為NH3,C為NO,D為NO2,E為HNO3,Z為H2O。
(1)本題中C、D的變化和D的相對分子質量比C的大16是題中一個最具有特征的條件,通過分析可初步判斷D比C多一個氧原子可知A為(NH4)2S;Y為O2;Z為H2O;
(2)當X是強酸時,根據上面的分析可知,E是 H2SO4,B生成C的化學方程式為2H2S+3O2![]() 2SO2+2H2O;
2SO2+2H2O;
(3)當X是強堿時,根據上面的分析可知,E是 HNO3,B生成C的化學方程式為4NH3+5O2 4NO+6H2O。
4NO+6H2O。


 周周清檢測系列答案
周周清檢測系列答案 輕巧奪冠周測月考直通高考系列答案
輕巧奪冠周測月考直通高考系列答案科目:高中化學 來源: 題型:
【題目】我國科學家開發設計一種天然氣脫硫裝置,利用如右圖裝置可實現:H2S+O2→H2O2 +S。已知甲池中有如下的轉化:


下列說法錯誤的是:
A. 該裝置可將光能轉化為電能和化學能
B. 該裝置工作時,溶液中的H+從甲池經過全氟磺酸膜進入乙池
C. 甲池碳棒上發生電極反應:AQ+2H+ +2e- =H2AQ
D. 乙池①處發生反應:H2S+I3- =3I-+S↓+2H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量純凈的氨基甲酸銨置于密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡H2NCOONH4(s) ![]() 2NH3(g)+CO2(g)。下列各項:①2v(NH3)=v(CO2) ②密閉容器中總壓強不變 ③密閉容器中混合氣體的密度不變 ④密閉容器中氨氣的體積分數不變 ⑤密閉容器中c(NH3)不變,能判斷該反應已經達到化學平衡狀態的是( )
2NH3(g)+CO2(g)。下列各項:①2v(NH3)=v(CO2) ②密閉容器中總壓強不變 ③密閉容器中混合氣體的密度不變 ④密閉容器中氨氣的體積分數不變 ⑤密閉容器中c(NH3)不變,能判斷該反應已經達到化學平衡狀態的是( )
A.②③⑤B.②③④C.①④D.全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期主族元素W、X、Y、Z的原子序數依次增大,W、X的簡單離子具有相同電子層結構,X的原子半徑是短周期主族元素原子中最大的,W與Y同族,Z與X形成的離子化合物的水溶液呈中性。下列說法正確的是( )
A.簡單離子半徑:![]()
B.W與X形成的化合物溶于水后溶液呈堿性
C.氣態氫化物的熱穩定性:![]()
D.最高價氧化物的水化物的酸性:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A~I分別表示中學化學中常見的一種物質,它們之間相互關系如下圖所示(部分反應物、生成物沒有列出)。已知H為固態氧化物,F是紅褐色難溶于水的沉淀,且A、B、C、D、E、F六種物質中均含同一種元素。

請填寫下列空白:
(1)A、B、C、D、E、F六種物質中所含的同一種元素的名稱是________。
(2)反應①的化學方程式為_____________________________________
反應③的離子方程式為________________________
反應⑧的化學方程式為_____________________________________
(3)反應⑥過程中的現象是______________________________。
(4)1molI發生反應后生成的A高溫下與足量的水蒸氣反應,生成的氣體換算成標準狀況下占______L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】部分短周期元素原子半徑的相對大小、最高正價或最低負價隨原子序數的變化關系如圖所示,下列說法正確的是

A. 離子半徑的大小順序:d<e<f
B. 與x形成簡單化合物的沸點:y>z>d
C. 除去實驗后試管中殘留的g單質,可用熱的氫氧化鈉溶液
D. g、h的氧化物對應的水化物的酸性:h>g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】釔的常見化合價為+3價,我國蘊藏著豐富的含釔礦石(Y2FeBe2Si2O10),工業上通過如下生產流程可獲得氧化釔。
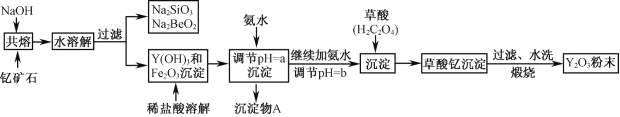
已知:①該流程中有關金屬離子形成氫氧化物沉淀時的pH見下表:
離子 | 開始沉淀時的pH | 完全沉淀時的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,鈹元素和鋁元素處于第二周期和第三周期的對角線位置,化學性質相似。
(1)寫出Na2SiO3的一種用途________________________。
(2)欲從Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好選用鹽酸和_______兩種試劑,再通過必要的操作即可實現。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 寫出Na2BeO2與足量鹽酸發生反應的離子方程式___________________________。
(3)常溫下,反應Fe3++3H2O(g) ![]() Fe (OH)3↓+3H+的平衡常數K= ______。為使Fe3+沉淀完全,用氨水調節pH=a時,a應控制在_________范圍內;繼續加氨水調節pH =b發生反應的離子方程式為____________________________。
Fe (OH)3↓+3H+的平衡常數K= ______。為使Fe3+沉淀完全,用氨水調節pH=a時,a應控制在_________范圍內;繼續加氨水調節pH =b發生反應的離子方程式為____________________________。
(4)煅燒草酸釔時發生分解反應,其固體產物為氧化釔,氣體產物能使澄清石灰水變渾濁。寫出草酸釔[Y2(C2O4)3·nH2O]煅燒的化學方程式___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】9.6g 元素A與4.2g元素B含有相同的原子數,A和B原子核中質子數與中子數相等,已知A元素在其最高價氧化物中的含量是40%,在其氫化物中含量為94.1%。試計算A、B兩元素的相對原子質量,并推算出它們在周期表中的位置。______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學用下列裝置進行有關Cl2的實驗。下列說法不正確的是( )
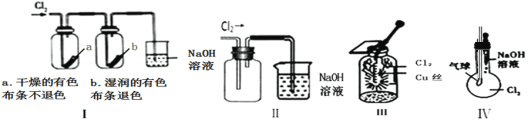
A.圖I中:實驗現象證明氯氣無漂白作用,氯水有漂白作用
B.圖II中:收集氯氣
C.圖IV中:若氣球干癟,證明可與NaOH溶液反應
D.圖III中:生成棕黃色的煙,加少量水溶解得到藍綠色溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com