
乙炔是重要的化工原料,廣泛用于有機合成和氧炔焊等。生產乙炔的方法有多種,如電石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的濃硝酸(硝酸被還原為NO2)在20~70℃時直接氧化為H2C2O4·2H2O。
①該反應的化學方程式為________________________;
②實際生產中硝酸可循環利用而不被消耗,用方程式說明:___________________。
(2)電石法原理為:由石油焦與生石灰在電爐中生成電石CaC2(含Ca3P2、CaS等雜質), 電石與水反應生成C2H4(含PH3及H2S等雜質)。
①已知焦炭固體與氧化鈣固體每生成l g CaC2固體,同時生成CO氣體吸收7.25kJ的 熱量,則該反應的熱化學方程式為_____________________________________;
②用CuSO4溶液凈化乙炔氣體,去除PH3的反應之一為:4CuSO4+PH3+4H2O===4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,該反應中轉移電子的物質的量為__________;
③反應H2S(aq)+Cu2+(aq)===CuS(s)+2H+(aq)的平衡常數為________________;(已知Ksp(CuS)=1.25×10-36,H2S的Kal=1×10-7,Ka2=1×10-13)
④電石法工藝流程簡單、容易操作、乙炔純度高,缺點是_______(舉1例)。
(3)甲烷裂解法原理為:2CH4(g) C2H2(g)+3H2(g)△H,實驗測得該反應的Kp(用平衡分壓代替濃度計算的平衡常數,分壓=總壓×物質的量分數)與溫度的關系如圖所示:
C2H2(g)+3H2(g)△H,實驗測得該反應的Kp(用平衡分壓代替濃度計算的平衡常數,分壓=總壓×物質的量分數)與溫度的關系如圖所示:
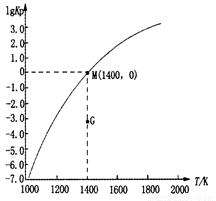
①該反應的△H________0(填“>”、“=”或“<”);
②圖中G點v(正)______v(逆)(填“>”、“=”或“<”);
③M點時,若容器中氣體的總物質的量為1 mol,則總壓P與n(CH4)、n(C2H2)及n(H2)之間的關系為_________。
 贏在課堂名師課時計劃系列答案
贏在課堂名師課時計劃系列答案 天天向上課時同步訓練系列答案
天天向上課時同步訓練系列答案科目:高中化學 來源:2017屆黑龍江省哈爾濱市高三二模理科綜合化學試卷(解析版) 題型:填空題
金屬鎵是一種廣泛用于電子工業和通訊領域的重要金屬,化學性質與鋁元素相似。
(1)工業上提純鎵的方法很多,其中以電解精煉法為多。具體原理如下:以待提純的粗鎵(內含Zn、Fe、Cu雜質)為陽極,以高純鎵為陰極,以NaOH水溶液為電解質溶液。在電流作用下使粗鎵在陽極溶解進入電解質溶液,并通過某種離子遷移技術到達陰極并在陰極放電析出高純鎵。
①已知離子氧化性順序為:Zn2+<Ga3+<Fe2+<Cu2+。電解精煉鎵時陽極泥的成分是_________________。
②GaO2-在陰極放電的電極方程式是_______________________。
(2)工業上利用柜臺Ga與NH3高溫條件下合成固體半導體材料氮化鎵(GaN)同時又有氫氣生成。反應中每生成3mol H2時就會放出30.8kJ熱量。
①該反應的熱化學方程式為__________________。
②一定條件下,加入一定量的Ga與NH3進行上述反應,下列敘述符合事實且可作為判斷反應已達到平衡狀態的標志的是_________________。
A.恒溫恒壓下,混合氣體的密度不變
B.斷裂3molH-H鍵,同時斷裂2molN-H鍵
C.恒溫恒壓下達平衡,加入2molH2使平衡移動,NH3的消耗速率等于原平衡時NH3的消耗速率
D.升高溫度,氫氣的生成速率先增大再減小,最后不變
(3)在密閉容器中,充入一定量的Ga與NH3發生反應,實驗測得反應平衡體系中NH3的體積分數與壓強的關系曲線如圖1所示。
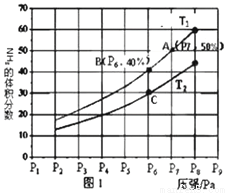
①比較圖1中A點和C點化學平衡常數的大小關系:K1A1________________K1C1,(填“<”、“=”或“>”),理由是________________________________
②在T1和P6的條件下,往密閉容器中充入2molNH3和足量的Ga,該反應在第5min時達到平衡,此時容器的體積為3L。
a.若溫度保持T1℃不變,壓強恒定在P7的條件下重新達到平衡狀態A(P7、50%)時,容器的體積變為起始體積的______________倍。
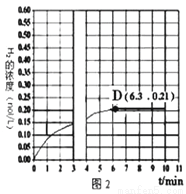
b.若T1和P6條件下反應至3min時刻,改變條件并與D點處達到平衡,H2的濃度隨反應時間的變化趨勢如圖2所示(3~4min的濃度變化未表示出來),則改變的條件為_________(僅改變溫度或壓強中的一種)
(4)在工業上利用N2(g)+3H2(g)  2NH3(g)合成氮氣。對于氣相反應,用某組份(B)的平衡壓強(PB)代替物質的量濃度(CB)也可以表示平衡常數(記作Kp),且PB=P×B的體積分數。則該反應的化學平衡常數表達式(Kp)是_____。恒溫恒壓下,在一容積可變的容器中,該反應達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3molN2,則平衡_________移動(填“正向”、“逆向”或“不”)。
2NH3(g)合成氮氣。對于氣相反應,用某組份(B)的平衡壓強(PB)代替物質的量濃度(CB)也可以表示平衡常數(記作Kp),且PB=P×B的體積分數。則該反應的化學平衡常數表達式(Kp)是_____。恒溫恒壓下,在一容積可變的容器中,該反應達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3molN2,則平衡_________移動(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化學 來源:2017屆貴州省貴陽市高三下學期第六次適應性考試理綜化學試卷(解析版) 題型:選擇題
應用下列實驗裝置進行實驗,能達到目的的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省高二下學期第一次月考化學試卷(解析版) 題型:選擇題
中國著名藥學家屠呦呦因制成了青蒿素而獲得2015年度諾貝爾生理 學或醫學獎。青蒿素的結構如右圖,關于該物質的分類正確的是

A.單質 B.有機物
C.無機物 D.有機高分子化合物
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省高二下學期第一次月考化學試卷(解析版) 題型:選擇題
將一定體積的SO3(g)充入恒容的密閉容器中,發生反應2SO3(g) 2SO2(g)+O2(g)并達到平衡;保持溫度不變,再充入相同體積的SO3(g),達到新平衡后,與原平衡相比,下列值減小的是 ( )
2SO2(g)+O2(g)并達到平衡;保持溫度不變,再充入相同體積的SO3(g),達到新平衡后,與原平衡相比,下列值減小的是 ( )
A.平均相對分子質量 B.SO3(g)的轉化率
C.c(SO3)/c(SO2) D.c2(SO3)/[c2(SO2)·c(O2)]
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市高三(實驗班)第十次月考理綜化學試卷(解析版) 題型:選擇題
下列操作及解釋都正確的是
選項 | 應用 | 解釋 |
A | 在相同條件下,在兩支試管中各加入2 mL 5% H2O2溶液,再向H2O2溶液中分別滴入1 mL H2O和1 mL 0.1 mol·L-1 FeCl3溶液,對比觀察現象 | 可以探究催化劑FeCl3對H2O2 分解速率的影響 |
B | 向盛有1mL 0.01 mol·L-1 AgNO3溶液的試管中滴加5滴0.01 mol·L-1 NaCl溶液,有白色沉淀生成,再向其中滴加0.01 mol·L-1 KI溶液,產生黃色沉淀。 | 常溫下,Ksp(AgCl)> Ksp(AgI) |
C | 向兩份蛋白質溶液中分別滴加飽和NaCl溶液和CuSO4溶液,均有固體析出 | 蛋白質均發生變性 |
D | 保存硫酸亞鐵溶液需加入少量稀鹽酸和鐵釘 | 防止 Fe2+水解以及被 O2 氧化 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省高二3月月考化學試卷(解析版) 題型:推斷題
利用乙醇和甲苯為原料,可按下列路線合成分子式均為C9H10O2的有機化工產品E和J。

已知:
請回答:
(1)寫出下列反應方程式
①B+D→E______。
②G→H______。
(2)②的反應類型為______;F的官能團名稱為______。
(3)E、J有多種同分異構體,符合下列條件的同分異構體有______種:
①與E、J屬同類物質②苯環上有兩個取代基且苯環上的一氯代物只有兩種。
寫出其中酸催化水解產物能與FeCl3溶液發生顯色反應的結構簡式______。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省高二3月月考化學試卷(解析版) 題型:選擇題
NA表示阿伏伽德羅常數的值,下列敘述正確的是( )
A. 1mol —CH3(甲基)中含有的電子數為10NA
B. 標準狀況下,22.4 L C3H8中含共價鍵的數目為8 NA
C. 標準狀況下,22.4 L苯中含C—H數目為6 NA
D. 184g 甘油與足量的鈉反應生成H2的數目為3 NA
查看答案和解析>>
科目:高中化學 來源:海南省、文昌中學2017屆高三下學期聯考化學試卷 題型:選擇題
常溫下,向20mL的某稀H2SO4溶液中滴入0.1mol/L氨水,溶液中水電離出氫離子濃度隨滴入氨水體積變化如圖。下列分析正確的是
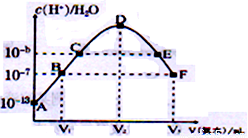
A. 稀硫酸的初始濃度為0.1mol/L B. V2=20mL
C. E溶液中存在:c(OH-)>c(H+) D. C點溶液pH=14-b
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com