
 研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.
研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.分析 (1)平衡狀態時,正逆反應速率相等,各物質的濃度不變,由此衍生的一些物理量也不變;
(2)利用三段法計算平衡時的濃度來計算化學平衡常數;
(3)利用化學平衡的影響因素和工業生產的關系來分析.
解答 解:(1)a.無論是否達到平衡,體系壓強都保持不變,不能用于判斷是否達到平衡狀態,故a錯誤;
b.混合氣體顏色保持不變,說明濃度不變,達到平衡狀態,故b正確;
c.SO3和NO的計量數之比為1:1,無論是否達到平衡,二者的體積比保持不變,不能判斷是否達到平衡狀態,故c錯誤;
d.物質的量之比等于化學計量數之比,則每消耗1mol SO3的同時生成1molNO2,不能判斷是否達到平衡狀態,故d錯誤.
故答案為:b;
(2)設加入的二氧化氮的物質的量為a,則二氧化硫的為2a,
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物質的量 1a 2a 0 0
轉化物質的量 x x x x
平衡物質的量 a-x 2a-x x x
則(a-x):(2a-x)=1:6,x=$\frac{4a}{5}$,則平衡時,C( NO2)=$\frac{a-x}{V}$mol/L=$\frac{a}{5V}$,C(SO2)=$\frac{2a-x}{V}$=$\frac{6a}{5V}$,
C(SO3)=C(NO)=$\frac{4a}{5V}$,平衡常數K=$\frac{\frac{4a}{5V}•\frac{4a}{5V}}{\frac{a}{5V}•\frac{6a}{5V}}$=$\frac{8}{3}$,故答案為:a$\frac{8}{3}$;
(3)由圖可知,溫度升高,CO的轉化率降低,平衡向逆反應方向移動,故逆反應是吸熱反應,正反應是放熱反應,△H<0;壓強大,有利于加快反應速率,有利于使平衡正向移動,但壓強過大,需要的動力大,對設備的要求也高,故選擇250℃、1.3×104kPa左右的條件.因為在250℃、壓強為1.3×104 kPa時,CO的轉化率已較大,再增大壓強,CO的轉化率變化不大,沒有必要再增大壓強.
故答案為:<,在1.3×104kPa下,CO的轉化率已較高,再增大壓強CO的轉化率提高不大,而生產成本增加得不償失.
點評 該題將元素化合物與化學平衡等知識柔和在一起進行考察,充分體現了高考的綜合性,第(3)容易出錯,需認真分析圖象,注意圖象的變化趨勢及縱橫坐標的含義,從而得出正確結論.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④ | B. | ①④⑤ | C. | ③④⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增加Fe的量,正反應速率增大 | |
| B. | 將容器的體積縮小一半,正逆反應速率增大 | |
| C. | 保持體積不變,充入Ne,正逆反應速率增大 | |
| D. | 保持壓強不變,充入Ne,正逆反應速率不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
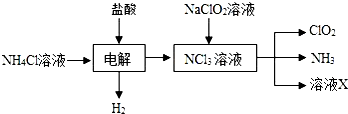

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 選項 | 不純物質(雜質) | 除雜試劑或分離方法 | 必用儀器 |
| A | 碘水 | 四氯化碳 萃取 | 分液漏斗 |
| B | 一氧化碳(二氧化碳) | 澄清石灰水 洗氣 | 洗氣瓶 |
| C | 硝酸鉀(氯化鈉) | 直接蒸發結晶 | 蒸發皿 |
| D | 乙醇(水) | 生石灰 蒸餾 | 蒸餾燒瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某研究小組向2L密閉容器中加入一定量的固體A和氣體B發生反應:
某研究小組向2L密閉容器中加入一定量的固體A和氣體B發生反應:時間(min) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com