
【題目】已知O、S、Se、Te、Po、Lv是同主族元素,其原子序數(shù)依次增大。回答下列問題:
(1)Lv在周期表中的位置是_________。
(2)下列有關(guān)性質(zhì)的比較,能用元素周期律解釋的是_________。
a.離子半徑:Te2->Se2- b.熱穩(wěn)定性:H2O>H2S
c.熔、沸點:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)從原子結(jié)構(gòu)角度解釋Se與S的最高價氧化物對應的水化物酸性不同的原因_________。
(4)實驗室用如下方法制備H2S并進行性質(zhì)驗證。
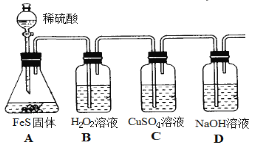
①設(shè)計B裝置的目的是證明_________,B中實驗現(xiàn)象為_______________。
②實驗中經(jīng)檢測發(fā)現(xiàn)C中溶液pH降低且出現(xiàn)黑色沉淀。C中反應的離子方程式是_______________。
③有同學根據(jù)“強酸制弱酸”原理認為裝置A、C中兩個反應相矛盾,認為C中不可能出現(xiàn)上述現(xiàn)象。該觀點不正確的理由是_______________。
【答案】第七(或7)周期VIA族 abd Se與S是同主族元素,Se比S電子層數(shù)多、半徑大,吸引電子能力弱,非金屬性弱,故H2SeO4酸性弱于H2SO4 H2S具有還原性 出現(xiàn)淡黃色(或乳白色)沉淀(或渾濁) Cu2++H2S==CuS↓+2H+ 該反應發(fā)生的原因是生成了難溶的CuS沉淀,不是因為生成弱電解質(zhì)
【解析】
(1)根據(jù) O、S、Se、Te、Po、Lv都是氧族元素,且原子序數(shù)依次增大分析解答;
(2)根據(jù)元素的非金屬性、氫化物的穩(wěn)定性、最高價氧化物的水化物的酸性等元素周期律的變化規(guī)律分析判斷;
(3)Se與S是同主族元素,最外層電子數(shù)相等,Se比S電子層數(shù)多、半徑大,結(jié)合核對最外層電子的吸引力的變化,引起非金屬性的變化分析解答;
(4)①雙氧水具有較強的氧化性,H2S具有還原性;②硫化氫能夠與硫酸銅反應生成黑色不溶于硫酸的CuS沉淀;③結(jié)合裝置A和C中發(fā)生反應的原理分析解答。
(1) O、S、Se、Te、Po、Lv是同主族元素,都是氧族元素,位于第VIA族,O、S、Se、Te、Po、Lv是同主族元素,其原子序數(shù)依次增大,因此Lv位于第七(或7)周期,在周期表中的位置為,故答案為:第七(或7)周期VIA族;
(2)a.同一主族元素,從上到下,離子半徑逐漸增大,因此離子半徑:Te2->Se2-,能用元素周期律解釋,故a選;b.同一主族元素,從上到下,非金屬性逐漸減弱,氫化物的穩(wěn)定性減弱,因此熱穩(wěn)定性:H2O>H2S,能用元素周期律解釋,故b選;c.物質(zhì)的熔沸點是物理性質(zhì),不能用元素周期律解釋,故c不選;d.同一主族元素,從上到下,非金屬性逐漸減弱,最高價含氧酸的酸性減弱,因此酸性:H2SO4>H2SeO4,能用元素周期律解釋,故d選;故答案為:abd;
(3)Se與S是同主族元素,Se比S電子層數(shù)多、半徑大,吸引電子能力弱,非金屬性弱,故H2SeO4酸性弱于H2SO4,故答案為:Se與S是同主族元素,Se比S電子層數(shù)多、半徑大,吸引電子能力弱,非金屬性弱,故H2SeO4酸性弱于H2SO4;
(4)①雙氧水具有較強的氧化性,H2S具有還原性,能夠被雙氧水氧化生成硫單質(zhì)沉淀,故答案為:H2S具有還原性;出現(xiàn)淡黃色沉淀;
②硫化氫能夠與硫酸銅反應生成黑色不溶于硫酸的CuS沉淀,反應的離子方程式為Cu2++H2S==CuS↓+2H+,故答案為:Cu2++H2S==CuS↓+2H+;
③根據(jù)“強酸制弱酸”的原理,裝置A中硫化亞鐵與硫酸反應生成硫化氫,因為硫化亞鐵能夠被硫酸溶解,C中發(fā)生Cu2++H2S==CuS↓+2H+,是因為生成的硫化銅不能溶于硫酸,因此該反應能夠發(fā)生,故答案為:該反應發(fā)生的原因是生成了難溶的CuS沉淀,不是因為生成弱電解質(zhì)。


科目:高中化學 來源: 題型:
【題目】根據(jù)下面的反應路線及所給信息,回答下列問題:
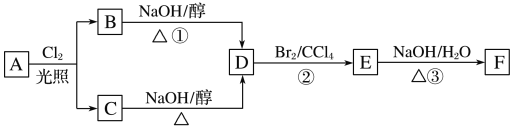
(1)標準狀況下的氣態(tài)烴A11.2L在氧氣中充分燃燒可以產(chǎn)生66gCO2和36gH2O,則A分子式的是__________。
(2)B和C均為一氯代烴,它們的名稱(系統(tǒng)命名)分別為__________。
(3)D的結(jié)構(gòu)簡式為________________。
(4)E的一個同分異構(gòu)體的結(jié)構(gòu)簡式是________。(寫一個即可)
(5)①、②、③的反應類型依次是_______。
(6)寫出③反應的化學方程式:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】傘形酮可用作酸堿指示劑,可由雷瑣苯乙酮和蘋果酸在一定條件下反應制得。下列說法中錯誤的是
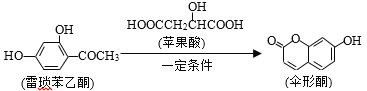
A.1mol傘形酮與足量NaOH溶液反應,最多可消耗3molNaOH
B.1 mol雷瑣苯乙酮最多可與4 mol H2發(fā)生加成反應
C.蘋果酸發(fā)生縮聚反應最多可生成2種高分子化合物
D.雷瑣苯乙酮在一定條件下可發(fā)生氧化、取代、縮聚等反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫是重要而潔凈的能源。要利用氫氣作為能源,必須解決好儲存氫氣的問題。化學家研究出利用合金儲存氫氣的方法,其中鑭(La)鎳(Ni)合金是一種儲氫材料,這種合金的晶體結(jié)構(gòu)已經(jīng)測定,其基本結(jié)構(gòu)單元如圖所示,則該合金的化學式可表示為( )
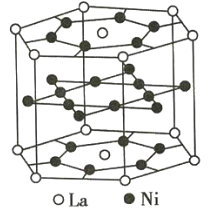
A.LaNi5B.LaNiC.La14Ni24D.La7Ni12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用太陽能電解水制H2是解決能源危機的重要方向。采用固體氧化還原調(diào)節(jié)劑作為離子交換體系,實現(xiàn)H2、O2分離。下列分析正確的是( )
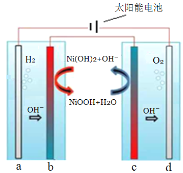
A.左側(cè)電解池應選用酸性溶液,a極反應式為:2H+ + 2e-=H2↑
B.b極反應式:NiOOH + H2O + e-=Ni(OH)2 + OH-
C.c為陽極,發(fā)生氧化反應
D.電解一段時間后,可將b、c對調(diào),循環(huán)利用物質(zhì)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據(jù)雜化軌道理論和價電子對互斥理論模型判斷,下列分子或離子的中心原子雜化方式及空間構(gòu)型正確的是( )
選項 | 分子或離子 | 中心原子雜化方式 | 價電子對互斥理論模型 | 分子或離子的空間構(gòu)型 |
A | H2O | sp1 | 直線形 | 直線形 |
B | BBr3 | sp2 | 平面三角形 | 三角錐形 |
C | PCl3 | sp2 | 四面體形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素W、X、Y、Z的原子序數(shù)依次增大,W、X原子的最外層電子數(shù)之比為4∶3,Z原子的核外電子數(shù)比X原子多4。下列說法正確的是( )
A.W、Y、Z的電負性大小順序一定是Z>Y>W
B.Z的氫化物分子間存在氫鍵
C.Y、Z形成的化合物分子的中心原子可能采取sp3雜化
D.WY2分子中σ鍵與π鍵的數(shù)目之比一定是2∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某原子晶體的空間結(jié)構(gòu)中的一部分如圖所示。該原子晶體與某物質(zhì)B反應生成C,其實質(zhì)是在每個A—A鍵中插入一個B原子,則C的化學式為( )
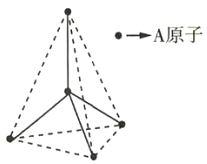
A.ABB.A5B4C.AB2D.A2B5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國是世界產(chǎn)鎂大國,金屬鎂的產(chǎn)量居世界前列。一種由白云石(主要成分為CaOMgO,含少量SiO2、A12O3、Fe2O3等雜質(zhì))冶煉金屬鎂的工藝流程如圖:
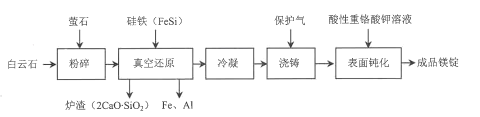
已知:螢石的主要成分是CaF2,用于降低真空還原反應的活化能。
回答下列問題:
(1)①粉碎的主要目的________。
②螢石在真空還原反應中的作用是________(填標號)。
A.氧化劑 B.還原劑 C.催化劑
(2)Mg2+、Ca2+、Fe3+、Fe2+、A13+五種離子的氧化性由強到弱的順序為Fe3+>Fe2+>___(用離子符號表示)。
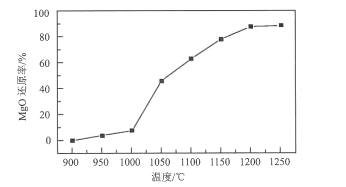
(3)結(jié)合流程以及如圖溫度對MgO還原率的影響關(guān)系,真空還原反應溫度的最佳選擇為___;高溫真空還原時,CaO、MgO和FeSi反應生成單質(zhì)鎂的化學方程式為___。
(4)液態(tài)鎂澆鑄成鎂錠時,通入的保護氣不可選用N2或CO2,其原因是_______。
(5)鎂錠冷卻后,用酸性K2Cr2O7溶液進行表面鈍化形成致密的氧化物保護膜,還原產(chǎn)物為Cr3+。該反應的離子方程式為________。
(6)為測定鎂錠的純度,稱取a g除去氧化膜的成品鎂錠樣品溶于足量稀硫酸中,配成250 mL溶液。取25 mL該溶液,用0.1000 mol/L的EDTA標準溶液進行滴定(雜質(zhì)不干擾滴定),三次滴定平均消耗EDTA標準溶液V mL(己知Mg2+與EDTA反應的化學計量數(shù)之比為1:1)。該樣品的純度為___%。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com