
科目:高中化學 來源:2017屆河北省石家莊市高三下學期模擬聯考理科綜合化學試卷(解析版) 題型:簡答題
現有A、B、C、D、E、F原子序數依次增大的六種元素,它們位于元素周期表的前四周期。B元素含有3個能級,且毎個能級所含的電子數相間;D的原子核外有8個運動狀態不同的電子;E元素與F元素處于同一周期相鄰的族,它們的原子序數相差3,且E元素的基態原子有4個未成對電子。請回答下列問題:
(1)請寫出:D基態原子的價層電子排布圖__________;F基態原子的外圍電子排布式:_________。
(2)下列說法錯誤的是_________。
A.二氧化硅的相對分子質量比二氧化碳大,所以沸點:SiO2>CO2
B.電負性順序:B<C<D
C.N2與CO為等電子體,結構相似。
D.穩定性:H2O>H2S,水分子更穩定的原因是水分子間存在氫鍵
(3)F離子是人體內多種酶的輔因子,人工模擬酶是當前研究的熱點。向F硫酸鹽溶液中通入過量的C與A形成的氣體X可生成[F (X)4]2+,該離子的結構式為______(用元素符號表示)。
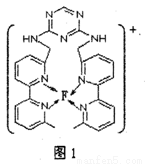
(4)某化合物與F(I)(I表示化合價為+1)結合形成圖1所示的離子,該離子中碳原子的雜化方式有________。
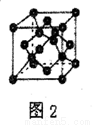
(5)B單質的一種同素異形體的晶胞如圖2所示,則一個晶胞中所含B原子數為_______。
(6)D與F形成離子個數比為1:1的化合物,晶胞與NaCl類似,設D離子的半徑為a pm, F離子的半徑b pm,求該晶胞的空間利用率________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省成都簡陽市高二上學期期末檢測化學試卷(解析版) 題型:選擇題
可逆反應∶2NO2 2NO+O2在固定體積密閉容器中反應,達到平衡狀態的標志是( )
2NO+O2在固定體積密閉容器中反應,達到平衡狀態的標志是( )
①單位時間內生成n molO2的同時生成2n molNO2
②單位時間內生成n molO2 的同時,生成2n mol NO
③用NO2、NO、O2 的物質的量濃度變化表示的反應速率的比為2 : 2 : 1的狀態
④混合氣體的顏色不再改變的狀態
⑤混合氣體的密度不再改變的狀態
⑥混合氣體的平均相對分子質量不再改變的狀態
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化學 來源:山東省2016-2017學年高一3月月考化學試卷 題型:選擇題
下列有關能量的說法不正確的是( )
A. 化石能源物質內部貯存著大量的能量
B. 植物的光合作用使太陽能轉化為化學能
C. 由石墨制金剛石是吸熱反應,故石墨能量比金剛石能量低
D. 燃料燃燒時只是將化學能轉化為熱能
查看答案和解析>>
科目:高中化學 來源:山東省2016-2017學年高一3月月考化學試卷 題型:選擇題
下列反應的離子方程式書寫正確的是( )
A. 鋁片放入氧氧化鈉溶液中:Al+2OH-+6H2O=2[A1(OH)4]- +3H2↑
B. Na與水反應:Na+2H2O=Na++ H2↑+2OH-
C. 向A1C13溶液中加入過量NaOH溶液:Al3++3OH-=Al(OH)3↓
D. A1C13溶液中滴入過量的氨水:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省咸陽市高三二模理綜化學試卷(解析版) 題型:填空題
1.
納米級Cu2O由于具有優良的催化性能而備受關注,下表為制取納米級Cu2O的三種方法:
窗體頂端
方法Ⅰ | 用炭粉在高溫條件下還原CuO |
方法Ⅱ | 電解法,反應為2Cu+H2O |
方法Ⅲ | 用肼(N2H4)還原新制Cu(OH)2 |
(1)工業上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反應條件不易控制,若控溫不當易生成________而使Cu2O產率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
則方法Ⅰ發生的反應:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_____。
(3)方法Ⅱ采用離子交換膜控制電解液中OH-的濃度而制備納米Cu2O,電解裝置如下圖所示。
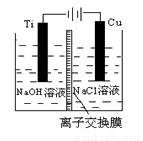
①陰極上的產物是________ 。
②陽極生成Cu2O,其電極反應式為_________。
(4)方法Ⅲ為加熱條件下用液態肼(N2H4)還原新制Cu(OH)2來制備納米級Cu2O,同時放出N2,該反應的化學方程式為____________。
(5)肼又稱聯氨,易溶于水,是與氨類似的弱堿,用電離方程式表示肼的水溶液顯堿性的原因______。
(6)向1L恒容密閉容器中充入0.1molN2H4,在30℃、Ni-Pt催化劑作用下發生反應N2H4(g) N2(g)+2H2(g),測得混合物體系中,
N2(g)+2H2(g),測得混合物體系中,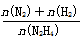 (用y表示)與時間的關系如圖所示。0-4min時間內H2的平均生成速率v(H2)=____mol/(L·min);該溫度下,反應的平衡常數=_______。
(用y表示)與時間的關系如圖所示。0-4min時間內H2的平均生成速率v(H2)=____mol/(L·min);該溫度下,反應的平衡常數=_______。
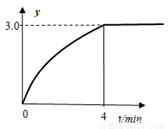
(7)肼-空氣清潔燃料電池是一種堿性燃料電池,電解質溶液時20%-30%的KOH溶液。肼-空氣燃料電池放電時,負極的電極反應式是_________。電池工作一點時間后,電解質溶液的pH將_______(填“增大”、“減小”、“不變”)。
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省咸陽市高三二模理綜化學試卷(解析版) 題型:選擇題
下列有關說法正確的是
A. 分子式為C5H12O的有機物,分子中含有2個甲基的同分異構體有4種
B. 乙烷、苯、氯乙烯等三種有機化合物分子內所有原子均在同一平面上
C. 由乙酸和乙醇制乙酸乙酯的反應及油脂的水解反應均屬于取代反應
D. 乙烯和苯都能使溴水褪色,且褪色的原理相同
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省南京市、鹽城市高三第二次模擬考試化學試卷(解析版) 題型:實驗題
溴化鈣晶體(CaBr2·2H2O)為白色固體,易溶于水,可用于制造滅火劑、制冷劑等。一種制備溴化鈣晶體的工藝流程如下:
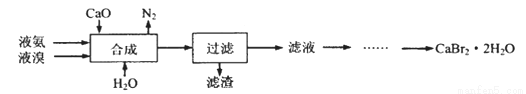
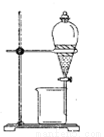
(1)實驗室模擬海水提溴的過程中,用苯萃取溶液中的溴,分離溴的苯溶液與水層的操作是(裝置如下圖):使玻璃塞上的凹槽對準漏斗上的小孔,將活塞擰開,使下面的水層慢慢流下,待有機層和水層界面與活塞上口相切即關閉活塞,______________。
(2)“合成”的化學方程式為___________________。 “合成”溫度控制在70℃以下,其原因是__________。投料時控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“濾渣”的主要成分為_________________(填化學式)。
(4)“濾液”呈強堿性,其中含有少量BrO-、BrO3-,請補充從“濾液”中提取CaBr2·2H2O的實驗操作:加熱驅除多余的氨,______________。[實驗中須使用的試劑有:氫溴酸、活性炭、乙醇;除常用儀器外須使用的儀器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化學 來源:2016-2017學年陜西省西安市高二下學期第一次教學檢測化學試卷(解析版) 題型:實驗題
溴苯是一種常用的化工原料。實驗室制備溴苯的實驗步驟如下:
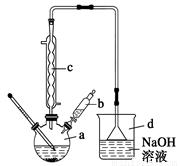
步驟1:在a中加入15 mL苯和少量鐵屑,再將b中4.0 mL液溴慢慢加入到a中,充分反應。,有___________(填現象)產生; 將b中的液溴慢慢加入到a中,而不能快速加入的原因是___________,繼續滴加液溴滴完。裝置d的作用是___________________;
步驟2:向a中加入10 mL水,然后________(填操作名稱)除去未反應的鐵屑。
步驟3:濾液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗滌,分液得粗溴苯。NaOH溶液洗滌的作用是____________;
步驟4:向分出的粗溴苯中加入少量的無水氯化鈣,靜置、過濾即得粗產品。加入氯化鈣的目的是______________;
已知苯、溴苯的有關物理性質如上表:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸點/℃ | 80 | 59 | 156 |
在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(1)實驗裝置中,儀器c的名稱為_____,作用是冷凝回流,回流的主要物質有___________________(填化學式)
(2)步驟4得到的粗產品中還含有雜質苯,,則要進一步提純粗產品,還必須進行的實驗操作名稱是__________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com