
| A. | 2.4g金屬鎂變成鎂離子時失去的電子數目為0.1NA | |
| B. | 標準狀況下,2.24LBr2所含的分子數為0.1NA | |
| C. | 室溫下,32gO2和O3的混合氣體中含有的氧原子數為2NA | |
| D. | 1.0mol•L-1的Na2CO3溶液中含有的Na+離子數目為2NA |
分析 A.2.4g金屬鎂物質的量=$\frac{2.4g}{24g/mol}$=0.1mol,鎂原子最外層2個電子,反應時失去2個電子達到穩定結構;
B.標準狀況下溴單質的狀態不是氣體,題中條件無法計算溴的物質的量;
C.O2和O3均由氧原子構成;
D.溶液體積不知不能計算微粒數.
解答 解:A、鎂原子最外層電子數為2,2.4g金屬鎂物質的量=$\frac{2.4g}{24g/mol}$=0.1mol,變成鎂離子時失去的電子數目為0.2NA,故A錯誤;
B.在標況下,溴單質不是氣體,不能使用標準狀況下的氣體摩爾體積計算溴的物質的量,故B錯誤;
C.O2和O3均由氧原子構成,故32g混合物中含有的氧原子的物質的量為n=$\frac{32g}{16g/mol}$=2mol,個數為2NA個,故C正確;
D.1.0mol•L-1的Na2CO3溶液體積不知,不能計算微粒數,故D錯誤;
故選C.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,48gO3含有的氧原子數為3NA | |
| B. | 1 mol OH-所含的電子數為9NA | |
| C. | 常溫常壓下,11.2 L氧氣所含的原子數為NA | |
| D. | 物質的量濃度為1mol/L MgCl2溶液,含有Cl-離子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 32 g O2氣體含有的氧原子數為NA | |
| B. | 2 L 0.3 mol/L Na2SO4溶液中含有Na+為0.6NA | |
| C. | 54 g鋁完全反應后失去的電子數為6NA | |
| D. | 11.2 L氮氣所含的分子數為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al3+,Na+,NO3-,Cl- | B. | K+,Na+,Cl-,NO3- | ||
| C. | K+,Na+,Cl-,AlO2- | D. | K+,NH4+,SO42-,NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ•mol-1 | |
| C. | CH4(g)+O2(g)═CO2(g)+H2O(l)△H=-890kJ•mol-1 | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=+890kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙中C的轉化率為75% | |
| B. | 反應.達到平衡前,甲中始終有V正>V逆,乙中始終有V正<V逆 | |
| C. | 在該條件下,反應2C(g)?A(g)+3B(g)的平衡常數為2.7×1.54 | |
| D. | 乙中的熱化學方程式為2C(g))?A(g)+3B(g)△H=+Q2kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
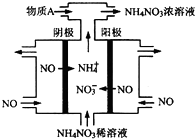 氮可形成多種氧化物,如NO、NO2、N2O4等.
氮可形成多種氧化物,如NO、NO2、N2O4等.| 時間/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
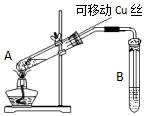 在探究Cu與濃H2SO4反應時,將質量8.0g可移動Cu絲部分伸入濃H2SO4中,充分反應后,Cu絲剩余4.8g,將試管A中液體稀釋成100ml溶液.該溶液中Cu2+物質的量濃度約為( )
在探究Cu與濃H2SO4反應時,將質量8.0g可移動Cu絲部分伸入濃H2SO4中,充分反應后,Cu絲剩余4.8g,將試管A中液體稀釋成100ml溶液.該溶液中Cu2+物質的量濃度約為( )| A. | 0.25mol•L-1 | B. | 0.5mol•L-1 | C. | 0.025mol•L-1 | D. | 0.05mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com