
(6分)已知某溫度下CH3COOH的電離常數K=1.6×10-5。該溫度下向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L KOH溶液,其pH變化曲線如下圖所示(忽略溫度變化)。請回答下列有關問題:
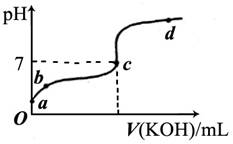
(1)a點溶液中c(H+)為 。
(2)b點溶液中離子濃度的大小順序可能有 種情況。
(3)a、b、c三點中水的電離程度最大的是 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| c2(CO) |
| c(CO2) |
| c2(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
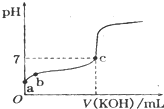 已知某溫度下CH3COOH的電離常數k=1.6×10-5,該溫度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH變化曲線如圖所示(忽略溫度變化),請回答有關問題.
已知某溫度下CH3COOH的電離常數k=1.6×10-5,該溫度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH變化曲線如圖所示(忽略溫度變化),請回答有關問題.查看答案和解析>>
科目:高中化學 來源: 題型:
常溫下,下列各溶液的敘述中正確的是( ▲ )
A.0.1mol·L-1的醋酸鈉溶液20 mL與0.1mol·L-1鹽酸10 mL混合后溶液顯酸性
c (CH3COO-)>c (Cl-)>c (CH3COOH)>c (H+)
B.pH=7的NaHSO3與Na2SO3混合溶液中:3c(Na+) = c(HSO![]() ) + c(SO
) + c(SO![]() )
)
C.已知酸性HF>CH3COOH,pH相等的NaF與CH3COOK溶液中:
[ c(Na+)-c(F一)] < [ c(K+)-c(CH3COO-) ]
D.已知某溫度下Ksp(CH3COOAg) = 2.8×10-3,濃度均為0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等體積混合一定能產生CH3COOAg沉淀。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com