平衡常數(K)是衡量某可逆反應在一定條件下反應進行程度的數值,它只受______影響,一定溫度下,以2A(g)+3B(g)?3C(g)+D(g))為例,平衡常數的表達式為K=______.現往1L的容器中通入CO2、H2各2mol.在一定條件下讓其發生反應:CO2+H2?CO+H2O,回答下列問題:
(1)在830℃條件下,反應達到平衡時CO2的濃度為1mol/L.該條件下平衡常數的值K1=______.
(2)在(1)基礎上,把體系的溫度降至800℃.已知該條件下的平衡常數K2=0.81,可以推知平衡向______移動,該可逆應的正反應為______反應(填吸熱或放熱),此時c(H2O)=______(保留2位有效數字).
(3)在(1)基礎上,壓縮容器體積至0.5L.該條件下的平衡常數為K3.則K3______K1(填“大于”“等于”“小于”)a
理由是______.
【答案】
分析:平衡常數只受溫度影響;
化學平衡常數,是指在一定溫度下,可逆反應達到平衡時各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值,據此書寫;
(1)利用三段式計算平衡時各組分的平衡濃度,代入平衡常數表達式計算;
(2)根據平衡常數的變化,判斷溫度對平衡移動的影響,進而判斷反應熱效應;
等效為開始為800℃到達的平衡,令平衡時水的濃度為xmol/L,根據三段式用x表示平衡時其它物質的濃度,再根據平衡常數列方程計算;
(3)平衡常數只受溫度影響,與壓強無關,溫度不變平衡常數不變.
解答:解:平衡常數只受溫度影響;2A(g)+3B(g)?3C(g)+D(g)的平衡常數的表達式為K=
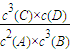
,
故答案為:溫度;
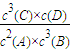
;
(1)平衡時CO
2的濃度為1mol/L,則:
CO
2(g)+H
2(g)?CO(g)+H
2O(g)
開始(mol/L):2 2 0 0
變化(mol/L):1 1 1 1
開始(mol/L):1 1 1 1
故830℃該反應的平衡常數k=

=1,
故答案為:1;
(2)降低溫度平衡常數減小,說明平衡向逆反應移動,故正反應為吸熱反應;
等效為開始為800℃到達的平衡,令平衡時水的濃度為xmol/L,則:
CO
2(g)+H
2(g)?CO(g)+H
2O(g)
開始(mol/L):2 2 0 0
變化(mol/L):x x x x
開始(mol/L):2-x 2-x x x
故

=0.81,解得x=0.95,
故答案為:逆反應方向;吸熱;0.95mol/L;
(3)平衡常數只受溫度影響,與壓強無關,溫度不變平衡常數不變,則K
3=K
1,
故答案為:等于;平衡常數只受溫度影響,與壓強無關.
點評:本題考查化學平衡常數的書寫、計算與影響因素等,難度中等,注意理解化學平衡常數及其應用.

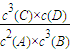 ,
,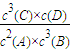 ;
; =1,
=1, =0.81,解得x=0.95,
=0.81,解得x=0.95,
