
| A. | 由Cu.Zn和稀硫酸組成的原電池工作時,若Cu極生成0.2gH2,則電路通過電子0.4NA | |
| B. | 18 g D2O中含有的質子數目為10NA | |
| C. | 1 mol Cl2發生反應時,轉移的電子數一定是2 NA | |
| D. | 常溫常壓下,16 g O3所含的原子數為NA |
分析 A.0.2g氫氣的物質的量為0.1mol,生成0.1mol氫氣轉移了0.2mol電子;
B.重水的摩爾質量為20g/mol;
C.氯氣反應可以只做氧化劑,也可以自身氧化還原反應;
D.質量轉換成物質的量,結合臭氧是由氧原子構成解答.
解答 解:A.0.2g氫氣的物質的量為0.1mol,生成0.1mol氫氣轉移了0.2mol電子,根據電子守恒,則電路通過電子0.2NA,故A錯誤;
B.重水的摩爾質量為20g/mol,故18g重水的物質的量為0.9mol,故含9NA個質子,故B錯誤;
C.1molCl2發生反應時,只做氧化劑,轉移的電子數一定2NA,自身氧化還原反應轉移電子1mol,故C錯誤;
D.常溫常壓下,16 g O3所含的原子數為$\frac{16g}{16g/mol}$×NA=NA,故D正確;
故選:D.
點評 本題考查了阿伏伽德羅常數的應用,掌握物質的量與阿伏伽德羅常數、摩爾質量等物理量之間的關系是解題關鍵,題目難度不大.


科目:高中化學 來源: 題型:選擇題
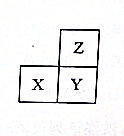
| A. | 最高正化合價:Z>X | |
| B. | X、Y、Z的單質中,Z的熔點最高 | |
| C. | 若X為非金屬元素,則離子半徑:Xn->Ym->Zm- | |
| D. | X、Y、Z的最高價氧化物對應水化物中,Y的堿性最強 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 金屬離子 | PH值 | |
| 開始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
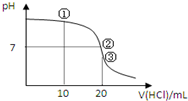 常溫下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲線如圖.下列說法正確的是( )
常溫下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲線如圖.下列說法正確的是( )| A. | ①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)>c(C1-)>c(OH-)=c(H+) | |
| C. | ③溶液:c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 滴定過程中可能出現:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 序號 | 物質 | 試劑 | 除雜方法 |
| ① | 甲烷(C2H4) | ||
| ② | 硝基苯(混合酸) | ||
| ③ | KNO3(NaCl) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將SO2通入品紅溶液,溶液褪色后加熱恢復原色;將SO2通入溴水,溴水褪色后加熱也能恢復原色 | |
| B. | 乙酸乙酯的制備實驗中,飽和Na2CO3溶液不僅可以降低乙酸乙酯的溶解度,還能吸收揮發出來的乙醇及乙酸 | |
| C. | “中和滴定”實驗中,容量瓶和錐形瓶用蒸餾水洗凈后即可使用,滴定管和移液管用蒸餾水洗凈后,必須干燥或潤洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可將混合氣體依次通過盛有酸性KMnO4溶液、濃硫酸的洗氣瓶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
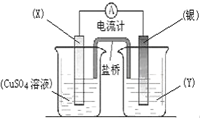 依據氧化還原反應:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)設計的原電池如圖所示.
依據氧化還原反應:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)設計的原電池如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 微粒半徑:K+>Al3+>S2->Cl- | B. | 離子的還原性:S2->Cl->Br->I- | ||
| C. | 酸性:HClO>H2SO4>H3PO4>H2CO3 | D. | 金屬性:K>Ca>Mg>Be |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在離核較遠區域的電子易失去,其原因是這些電子的能量較高 | |
| C. | 通過化學變化可以實現16O與18O間的相互轉化 | |
| D. | 對于吸收能量的反應必需加熱才能發生 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com