
| 時間/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
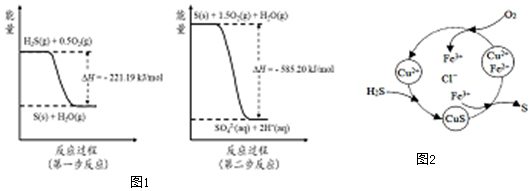
分析 (1)SO2的大量排放會形成酸雨,二氧化硫為酸性氧化物與水生成亞硫酸,亞硫酸為弱電解質,部分電離產生氫離子與亞硫酸氫根離子;
(2)由圖可知,第一步熱化學反應為:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJ•mol-1;
第二步反應為:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJ•mol-1;
依據蓋斯定律計算反應熱;
(3)①0-4min二氧化硫物質的量變化為0.10mol-0.050mol=0.050mol,反應速率v=$\frac{△c}{△t}$;
②結合圖表數據,5min時n(O2)=$\frac{0.10mol-0.04mol}{2}$=0.03mol,剩余氧氣物質的量=0.05mol-0.03mol=0.02mol,6min時氧氣物質的量為0.02mol,說明5分鐘反應達到平衡狀態,結合化學平衡三行計算列式計算平衡濃度,平衡常數=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;
③計算此時濃度商和平衡常數比較分析判斷平衡進行方向;
(4)根據使生成的硫單質中不含CuS,則硫離子不能有剩余,硫離子完全被氧化為硫單質進行分析;反應CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq),反應的平衡常數K=$\frac{c(C{u}^{2+})c({H}_{2}S)}{{c}^{2}({H}^{+})}$=$\frac{c(C{u}^{2+})c({S}^{2-})c({H}_{2}S)c(H{S}^{-})}{c({S}^{2-})c({H}^{+})c(H{S}^{-})c({H}^{+})}$=$\frac{Ksp(CuS)}{K{a}_{1}K{a}_{2}}$;
解答 解:(1)SO2的大量排放會引起嚴重的環境問題是形成酸雨,二氧化硫為酸性氧化物與水生成亞硫酸,亞硫酸為弱電解質,部分電離產生氫離子與亞硫酸氫根離子,離子方程式:SO2+H2O?H2SO3;H2SO3?H++HSO3-,
故答案為:酸雨;SO2+H2O?H2SO3;H2SO3?H++HSO3-;
(2)由圖可知,第一步熱化學反應為:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJ•mol-1;
第二步反應為:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJ•mol-1;
依據蓋斯定律,第一步與第二步方程式相加得:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJ•mol-1;
故答案為:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJ•mol-1 ;
(3)①0-4min二氧化硫物質的量變化為0.10mol-0.050mol=0.050mol,反應速率v=$\frac{\frac{0.050mol}{2L}}{4min}$=6.25×10-3mol/(L•min),故答案為:6.25×10-3mol/(L•min);
②結合圖表數據,5min時n(O2)=$\frac{0.10mol-0.04mol}{2}$=0.03mol,剩余氧氣物質的量=0.05mol-0.03mol=0.02mol,6min時氧氣物質的量為0.02mol,說明5分鐘反應達到平衡狀態,結合化學平衡三行計算列式計算平衡濃度,5min時,
2SO2(g)+O2(g)?2SO3(g),
起始量(mol) 0.1 0.05 0
變化量(mol) 0.06 0.03 0.06
平衡量(mol) 0.04 0.02 0.06
平衡常數=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$=$\frac{(\frac{0.06}{2})^{2}}{(\frac{0.04}{2})^{2}×\frac{0.02}{2}}$=225(mol/L)
故答案為:225(mol/L);
③8min時,維持溫度不變,往反應容器中再通入0.020mol SO2(g),0.010mol O2(g),Qc=$\frac{(\frac{0.06}{2})^{2}}{(\frac{0.04+0.02}{2})^{2}\frac{(0.02+0.01)}{2}}$=$\frac{200}{3}$=66.67<K,反應正向進行,平衡移動程度小重新達到平衡時混合氣體中SO2的百分含量將減小,故答案為:減小;
(4)①使生成的硫單質中不含CuS,則硫離子不能有剩余,硫離子完全被氧化為硫單質,所以氧氣必須過量,采取的措施是:增大混合氣體中空氣的比例,通入足量的空氣,
故答案為:通入足量的空氣;
②反應CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq),反應的平衡常數K=$\frac{c(C{u}^{2+})c({H}_{2}S)}{{c}^{2}({H}^{+})}$=$\frac{c(C{u}^{2+})c({S}^{2-})c({H}_{2}S)c(H{S}^{-})}{c({S}^{2-})c({H}^{+})c(H{S}^{-})c({H}^{+})}$=$\frac{Ksp(CuS)}{K{a}_{1}K{a}_{2}}$=$\frac{6.3×1{0}^{-36}}{1.3×1{0}^{-7}×7.1×1{0}^{-15}}$=6.83×10-15<10-5,反應很難進行,
故答案為:反應很難進行;
點評 本題考查了物質性質、熱化學方程式書寫、化學平衡計算、化學平衡常數和反應速率概念計算、影響平衡的因素判斷,溶度積常數的計算等知識點,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 準確稱取0.4000 g NaOH固體可配成100 mL 0.1000 mol•L-1的NaOH標準溶液 | |
| B. | 催化劑可以加快化學反應速率但不能改變化學反應的焓變 | |
| C. | 100 mL pH=3的HA和HB分別與足量的鋅反應,HB放出的氫氣多,說明HB酸性比HA弱 | |
| D. | 對于反應2SO2(g)+O2(g)?2SO3(g),壓縮氣體體積使壓強增大(其他條件不變),則SO2的轉化率增大,平衡常數K也增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將1mL飽和氯化鐵溶液逐滴加入到20mL溫水中,邊加邊攪拌 | |
| B. | 向Fe(OH)3膠體中加入少量H2SO4溶液,會生成紅褐色沉淀 | |
| C. | 可利用丁達爾效應區分膠體和溶液 | |
| D. | 膠體粒子具有較大的表面積,能吸附陽離子或陰離子,故在電場作用下會產生電泳現象 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
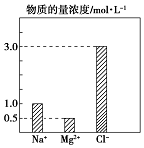 某100mL溶液中含有的部分離子濃度大小如圖所示,該溶液可能還含有Fe3+、Ba2+、H+、SO42-、CO32-.為了進一步確認,對該溶液進行實驗檢測:
某100mL溶液中含有的部分離子濃度大小如圖所示,該溶液可能還含有Fe3+、Ba2+、H+、SO42-、CO32-.為了進一步確認,對該溶液進行實驗檢測:| 實驗操作與現象 | 實驗結論 | 判斷理由 | |
| 步驟一 | 仔細觀察坐標圖 | 肯定無 CO32- | 肯定無該離子的理由碳酸根離子和鎂離子之間會反應 |
| 步驟二 | 該溶液呈無色、透明、均一狀態 | 肯定無 Fe3+ | 肯定無該離子的理由該離子為黃色 |
| 步驟三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42-、H+;肯定無Ba2+ | 肯定有H+的理由電荷守恒 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com