
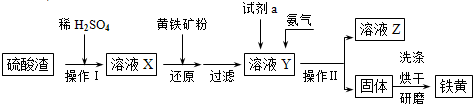
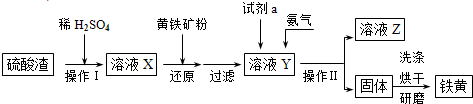
鐵黃是一種重要的顏料,化學式為Fe2O3·xH2O,廣泛用于涂料、橡膠、塑料、文教用品等工業。實驗室模擬工業利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黃鐵礦粉(主要成分為FeS2)制備鐵黃的流程如下:

(1)操作Ⅰ與操作Ⅱ中都用到玻璃棒,玻璃棒在兩種操作中的作用分別是 、 。
(2)試劑a最好選用 (供選擇使用的有:鋁粉、空氣、濃HNO3);其作用是 。
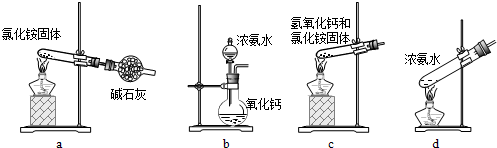
(3)上述步驟中需用到氨氣。下列裝置可用于實驗室制氨氣的是 (填序號)。

(4)檢驗溶液Z中含有 的方法是
。
的方法是
。
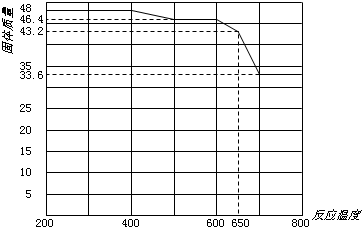
(5)查閱資料知,在不同溫度下Fe2O3被CO還原,產物可能為Fe3O4、FeO或Fe,固體質量與反應溫度的關系如下圖所示。

根據圖象推斷670℃時Fe2O3還原產物的化學式為 ,并設計一個簡單的實驗,證明該還原產物的成分(簡述實驗操作、現象和結論)。 。儀器自選。可供選擇的試劑:稀H2SO4、稀鹽酸、H2O2溶液、NaOH溶液、KSCN溶液。
(11分)(1)攪拌加速溶解(或攪拌加速反應)(1分)(只答攪拌也得分) 引流(1分)
(2)空氣(1分) 作氧化劑,將Fe2+氧化為Fe3+(1分)(答氧化劑、氧化Fe2+或將Fe2+轉化為Fe3+也得分)
(3)bd(2分)
(4)取少量溶液Z置于試管中,滴加過量濃NaOH溶液并微熱,將濕潤的紅色石蕊試紙靠近試管口,試紙變藍色,證明含有NH4+。(2分)(三個要點:濃NaOH溶液、濕潤的紅色石蕊試紙、變藍。缺一個要點扣1分)
(5)FeO(1分)取少量還原產物置于試管中,加入過量稀硫酸(或稀鹽酸),固體完全溶解且無氣泡產生;再向其中滴加KSCN溶液,溶液不變色;最后滴加H2O2溶液,溶液變紅色,證明還原產物為FeO。(2分)(要點:三組操作與現象、最終結論,少一個扣1分)
【解析】
試題分析:(1)操作Ⅰ是物質的溶解,操作Ⅱ是過濾,都需要用到玻璃棒,玻璃棒在兩種操作中的作用分別是,操作Ⅰ是利用玻璃棒加速硫酸渣的溶解,操作Ⅱ中玻璃棒是起到引流作用。
(2)依據流程分析,溶液Y中含有亞鐵離子,需要將其氧化成鐵離子,因此試劑a主要是用來氧化亞鐵離子的。但選擇氧化劑不能引入新的雜質,鋁粉引入新的雜質,濃硝酸做氧化劑會產生污染氣體,最好選擇空氣做氧化劑氧化亞鐵離子,不會引入新的雜質,不污染環境。
(3)a、加熱氯化銨分解后生成氨氣和氯化氫會在試管口重新生成氯化銨;不能制的氨氣,故a不能;
b、氨水滴入氧化鈣固體,氧化鈣會和水反應生成氫氧化鈣放熱,使一水合氨分解生成氨氣;故b符合;
c、氫氧化鈣和氯化銨固體加熱時需要試管口略向下傾斜,裝置中加熱會使生成的水倒流到試管底部炸裂試管;故c不選;
d、加熱濃氨水會分解生成氨氣,可以制取氨氣;故d符合,因此答案為bd。
(4)NH4+能和強堿反應生成氨氣,氨氣能使濕潤的紅色石蕊試紙變藍,通過檢驗氨氣的方法來檢驗NH4+,所以檢驗溶液Z中含NH4+的實驗方法是:取少量溶液Z置于試管中,滴加過量濃NaOH溶液并微熱,將濕潤的紅色石蕊試紙靠近試管口,試紙變藍色,證明含有NH4+。
(5)根據圖像可知,加熱前氧化鐵的物質的量是48g÷160g/mol=0.3mol。加熱到670℃時固體質量變為43.2g,即固體質量減少48g-43.2g=4.8g,減少的質量即為氧原子的質量,所以減少的氧原子質量是4.8g÷16g/mol=0.3mol,則根據原子守恒可知,反應后鐵原子和氧原子的個數之比是(0.3mol×2):(0.3mol×3-0.3mol)=1:1,所以該固體的化學式是FeO。要檢驗還原產物,可以通過檢驗亞鐵離子和鐵離子的方法來驗證,另外還需要排除單質鐵,所以正確的操作是取少量還原產物置于試管中,加入過量稀硫酸(或稀鹽酸),固體完全溶解且無氣泡產生;再向其中滴加KSCN溶液,溶液不變色;最后滴加H2O2溶液,溶液變紅色,證明還原產物為FeO。
考點:考查玻璃棒的作用、試劑的選擇、氨氣的制備和NH4+的檢驗、氧化鐵與CO反應生成物的判斷和計算、亞鐵離子和鐵離子的檢驗等


 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源: 題型:閱讀理解
| H | + 4 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年湖北省荊州市畢業班質量檢查(一)化學試卷(解析版) 題型:填空題
鐵黃是一種重要的顏料,化學式為Fe2O3·xH2 O,廣泛用于涂料、橡膠、塑料、文教用品等工業。實驗室模擬工業利用硫酸渣(含FeZ 0。及少量的CaO, Mg0等)和黃鐵礦粉
(主要成分為FeS2)制備鐵黃的流程如下:

(1)操作I與操作II中都用到玻璃棒,玻璃棒在兩種操作中的作用分別是_ 、
(2)試劑a最好選用_ (供選擇使用的有:鋁粉、空氣、濃HNO3 );其作用是_ 。
(3)上述步驟中需用到氨氣。下列裝置可用于實驗室制氨氣的是_ _(填序號)。

(4)查閱資料知,在不同溫度下Fe2 O3被CO還原,產物可能為Fe3 O4 、FeO或Fe,固體質量與反應溫度的關系如右圖所示。根據圖象推斷670℃時Fe2 O3還原產物的化學式為M,并設計一個簡單的實驗,證明該還原產物的成分(依次填寫每步操作中所加試劑的化學式、現象和結論)。儀器自選。可供選擇的試劑:稀H2SO4、稀鹽酸、H2 O2溶液、NaOH溶液、KSCN溶液。

|
加入試劑 |
現象 |
結論 |
|
|
|
則還原產物為 |
|
|
|
|
|
|
|
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

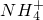 的方法是______.
的方法是______.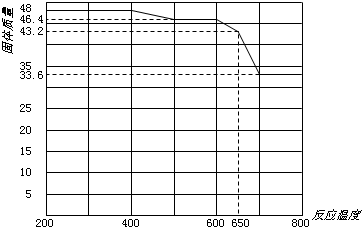
查看答案和解析>>
科目:高中化學 來源:山東省模擬題 題型:實驗題


 的方法是______________。
的方法是______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com