
【題目】下列現象與氫鍵有關的是( )
①![]() 的熔、沸點比
的熔、沸點比![]() 的高
的高
②乙醇能與水以任意比混溶,而乙硫醇(![]() )微溶于水
)微溶于水
③冰的密度比液態水的密度小
④鄰羥基苯甲酸的熔、沸點比對羥基苯甲酸的低
⑤![]() 比
比![]() 穩定
穩定
⑥接近沸點的水蒸氣的相對分子質量測量值大于實際值
A.①②③④⑥B.①②③④⑤C.②③④⑤D.①②③④⑤⑥
【答案】A
【解析】
![]() N的非金屬性強于P,
N的非金屬性強于P,![]() 分子之間存在氫鍵,熔化和氣化時,除克服分子間作用力外,還需克服氫鍵,導致
分子之間存在氫鍵,熔化和氣化時,除克服分子間作用力外,還需克服氫鍵,導致![]() 的熔、沸點比PH3高,
的熔、沸點比PH3高,![]() 正確;
正確;![]() 乙醇與水分子之間能形成氫鍵,可以和水以任意比互溶,硫醇(
乙醇與水分子之間能形成氫鍵,可以和水以任意比互溶,硫醇(![]() )與水之間不能形成氫鍵,在水中的溶解性小得多,
)與水之間不能形成氫鍵,在水中的溶解性小得多,![]() ;
;![]() 冰中存在氫鍵,增加了分子之間的距離,其體積變大,則相同質量時冰的密度比液態水的密度小,
冰中存在氫鍵,增加了分子之間的距離,其體積變大,則相同質量時冰的密度比液態水的密度小,![]() 正確;
正確;![]() 對羥基苯甲酸易形成分子之間氫鍵,而鄰羥基苯甲酸形成分子內氫鍵,所以鄰羥基苯甲酸的熔、沸點比對羥基苯甲酸的低,與氫鍵有關,
對羥基苯甲酸易形成分子之間氫鍵,而鄰羥基苯甲酸形成分子內氫鍵,所以鄰羥基苯甲酸的熔、沸點比對羥基苯甲酸的低,與氫鍵有關,![]() 正確;
正確;![]() H-O鍵鍵能比H-S鍵大,故
H-O鍵鍵能比H-S鍵大,故![]() 比
比![]() 更難分解,與氫鍵無關,
更難分解,與氫鍵無關,![]() 錯誤;
錯誤;
![]() 由于水分子之間存在氫鍵,使水分子通常以幾個分子聚合的形式存在,所以用測接近沸點的水蒸氣的相對分子質量測定值比用化學式
由于水分子之間存在氫鍵,使水分子通常以幾個分子聚合的形式存在,所以用測接近沸點的水蒸氣的相對分子質量測定值比用化學式![]() 計算出來的相對分子質量大,
計算出來的相對分子質量大,![]() 正確;
正確;
綜上所述,①②③④⑥均與氫鍵有關。
答案選A。


科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列說法不正確的是( )
A.過量的鐵在1molCl2中然燒,最終轉移電子數為2NA
B.在50g質量分數為46%的乙醇水溶液中,含氫原子總數為6NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反應中,生成28gN2時,轉移的電子數目為3.75NA
2HNO3+4N2↑+9H2O反應中,生成28gN2時,轉移的電子數目為3.75NA
D.1L1mol/LNaF溶液中F-的數目為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有容積均為2 L的甲、乙恒容密閉容器,向甲中充入1.5 mol CO2和3 mol H2,乙中充入2 mol CO2、3 mol H2,一定條件下僅發生反應:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),實驗測得反應體系中CO2的平衡轉化率與溫度的關系曲線如圖所示。下列說法正確的是
CH3OH(g)+H2O(g),實驗測得反應體系中CO2的平衡轉化率與溫度的關系曲線如圖所示。下列說法正確的是

A.該反應的ΔH>0
B.曲線Ⅱ表示甲容器中CO2的平衡轉化率與溫度的關系
C.500 K時,該反應的化學平衡常數為200
D.700 K時,若在上述密閉容器中充入0.9 mol CO2、1.2 mol H2、0.1 mol CH3OH、0.1mol H2O,則達到平衡時,H2的體積分數大于![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH3、NOx、SO2處理不當易造成環境污染,如果對這些氣體加以利用就可以變廢為寶,既減少了對環境的污染,又解決了部分能源危機問題。
(l)硝酸廠常用催化還原方法處理尾氣。CH4在催化條件下可以將NO2還原為N2。已知:
![]() ①
①
![]() ②
②
則反應![]() (1)△H=_______
(1)△H=_______
(2)工業上利用氨氣生產氫氰酸(HCN)的反應為:
①在一定溫度條件下,向2L恒容密閉容器中加入2 mol CH4和2 mol NH3,平衡時NH3體積分數為30%,所用時間為10 min,則該時間段內用CH4的濃度變化表示的反應速率為______ mol·L-l·min-1,該溫度下平衡常數K= ___。若保持溫度不變,再向容器中加入CH4和H2各1 mol,則此時v正 ___(填“>”“=”或“<”)v逆 。
②其他條件一定,達到平衡時NH3轉化率隨外界條件X變化的關系如圖1所示。X代表 ___(填字母代號)。
A 溫度 B 壓強 C 原料中CH4與NH3的體積比
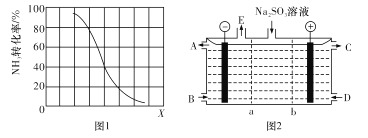
(3)某研究小組用NaOH溶液吸收尾氣中的二氧化硫,將得到的Na2SO3進行電解生產硫酸,其中陰、陽膜組合電解裝置如圖2所示,電極材料為石墨。A--E分別代表生產中的原料或產品,b表示____(填“陰”或“陽”)離子交換膜。陽極的電極反應式為_______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎授予三位開發鋰離子電池的科學家。某高能鋰離子電池的反應方程式為Li1-xCoO2+LixC6![]() LiCoO2+C6(x<l)。以該鋰離子電池為電源、苯乙酮為原料制備苯甲酸,工作原理如圖所示(注明:酸化電解后的苯甲酸鹽可以析出苯甲酸)。
LiCoO2+C6(x<l)。以該鋰離子電池為電源、苯乙酮為原料制備苯甲酸,工作原理如圖所示(注明:酸化電解后的苯甲酸鹽可以析出苯甲酸)。
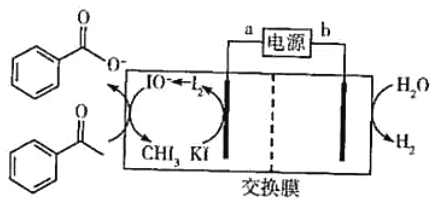
下列說法正確的是( )
A.鋰離子電池的a極為負極
B.放電時,正極反應式為xLi++xe-+Li1-xCoO2=LiCoO2
C.交換膜為質子交換膜
D.每產生4.48LH2(標準狀況),生成0.4molIO-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上利用廢鎳催化劑(主要成分為Ni,還含有一定量的Zn、Fe、SiO2、CaO等)制備草酸鎳晶體的流程如下:
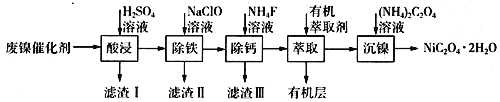
(1)請寫出一種能提高“酸浸”速率的措施:________________________;濾渣I的成分是____________(填化學式)。
(2)除鐵時,控制不同的條件可以得到不同的濾渣II。已知濾渣II的成分與溫度、pH的關系如圖所示:
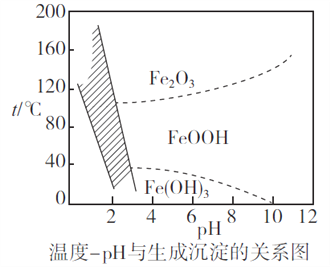
①若控制溫度40℃、pH=8,則濾渣II的主要成分為_________________________(填化學式)。
②若控制溫度80℃、pH=2,可得到黃鐵礬鈉[Na2Fe6(SO4)4(OH)12](圖中陰影部分),寫出生成黃鐵礬鈉的離子方程式:___________________________________________。
(3)已知除鐵后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,則所加c(NH4F)=_________mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有機萃取劑的作用是________________________。
(5)某化學鍍鎳試劑的化學式為MxNi(SO4)y(M為+1價陽離子,Ni為+2價,x、y均為正整數)。為測定該鍍鎳試劑的組成,進行如下實驗:
I.稱量28.7g鍍鎳試劑,配制100 mL溶液A;
Ⅱ.準確量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)標準溶液滴定其中的Ni2+(離子方程式為Ni2++H2Y2-=NiY2-+2H+),消耗EDTA標準溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL鍍鎳試劑時,需要的儀器除藥匙、托盤天平、玻璃棒、燒杯、量筒、膠頭滴管外,還需要________________________。
②該鍍鎳試劑的化學式為________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第四周期的 Cr、Fe、Co、Ni、Cu、Zn 等許多金屬能形成配合物。
(1)NH3 是一種很好的配體,氨氣分子是_____(填“極性”或“非極性”)分子,NH3 的沸 點_____(填“高于”“等于”或“低于”)AsH3。
(2)科學家通過 X 射線測得膽礬的結構示意圖可簡單表示如下:

圖中虛線表示的作用力為_________________________。
(3)膽礬溶液與氨水在一定條件下可以生成 Cu(NH3)4SO4H2O 晶體。在 Cu(NH3)4SO4·H2O 晶體中,含 有的原子團或分子有:[Cu(NH3)4]2+、NH3、 SO42 、H2O,[Cu(NH3)4]2+為平面正方形結構,則 VSEPR 模型為四面體結構的原子團或分子是_____________,其中心原子的雜化軌道類型是________________ 。
(4)金屬鎳粉在 CO 氣流中輕微加熱,生成無色揮發性液態 Ni(CO)4,呈正四面體構型。Ni(CO)4 易溶于_____________________ (填編號)。
a . 水 b. 四氯化碳 c. 苯 d. 硫酸鎳溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.鉛蓄電池放電時,負極質量減輕,正極增重
B.升高CH3COONa溶液的溫度,其水的離子積常數和pH均增大
C.CH3CH=CHCH3分子中的四個碳原子都在一條直線上
D.常溫下Ksp(AgBr)=5.0×10-13,Ksp(AgCl)=1.8×10-10,則S(AgBr)>S(AgCl)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列熱化學方程式:
Zn(s)+![]() O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
Hg(l)+![]() O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是( )
A.-441.8kJ·mol-1B.-254.6kJ·mol-1
C.-438.9kJ·mol-1D.-260.4kJ·mol-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com