
【題目】(1)氯化銨的水溶液顯弱酸性,其原因為___________________(用離子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固體,溶液的pH________(填“升高”或“降低”);若加入少量的明礬,溶液中的NH4+的濃度__________(填“增大”或“減小”);
(2)25℃,兩種酸的電離平衡常數如下表。
化學式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
電離常數 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物質的量濃度均為0.1 mol/L的四種溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的順序為__________(用編號填寫)。
②根據上表數據判斷,下列離子方程式錯誤的是__________。
A.CO2(過量)+H2O+ClO-=HCO3-+HClO B.SO2(過量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(過量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中離子濃度由大到小的順序為___________________。
④25℃時,NaCN與HCN的混合溶液,若c(CN-)=c(HCN),則溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃時,若向NaHSO3溶液中加入少量的I2,則溶液中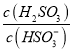 將__________(填“增大”“減小”或“不變”)。
將__________(填“增大”“減小”或“不變”)。
【答案】 NH4++H2O![]() NH3H2O+H+ 降低 增大 b>c>d>a B D c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) 9.3 增大
NH3H2O+H+ 降低 增大 b>c>d>a B D c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) 9.3 增大
【解析】(1)氯化銨的水溶液顯弱酸性是因為其中的銨根離子水解,所以方程式為:NH4++H2O![]() NH3H2O+H+。0.1 molL-1的氨水中加入少量的NH4Cl固體,因為銨根離子濃度增大,對于氨水的電離起到抑制作用,使溶液中的氫氧根離子濃度減小,溶液的pH降低。明礬電離的鋁離子的水解,對于銨根離子的水解起到抑制作用,所以銨根離子的水解減少,其濃度增大。
NH3H2O+H+。0.1 molL-1的氨水中加入少量的NH4Cl固體,因為銨根離子濃度增大,對于氨水的電離起到抑制作用,使溶液中的氫氧根離子濃度減小,溶液的pH降低。明礬電離的鋁離子的水解,對于銨根離子的水解起到抑制作用,所以銨根離子的水解減少,其濃度增大。
(2)①根據酸的電離平衡常數得到酸性強弱為:CH3COOH>H2CO3>HClO>HCO3-,根據越弱越水解的原理,得到堿性為:Na2CO3>NaClO>NaHCO3>CH3COONa,所以pH順序為:b>c>d>a。
②根據酸的電離平衡常數得到酸性強弱為:H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCN>HCO3-。方程式應該符合強酸制弱酸的原則。因為H2CO3>HClO,選項A正確(過量二氧化碳,保證生產碳酸氫根)。HClO有強氧化性,一定會將+價的S氧化,所以選項B錯誤。因為H2CO3>HCN>HCO3-,所以選項C正確(因為HCN>HCO3-,所以不能生成HCN和CO32-)。因為H2SO3>HSO3->HCN,所以選項D的反應應該得到SO32—和HCN,選項D錯誤。因為HSO3->HCO3-,所以通入少量SO2應該可以將碳酸根轉化為碳酸氫根,本身變為SO32-,選項E正確。因為H2SO3>H2CO3>HSO3-,所以通入SO2過量應該可以將碳酸鈉轉化為二氧化碳,選項F正確(SO2過量,所以一定得到HSO3-)。
③0.10 molL-1Na2SO3溶液中,鈉離子濃度最大,其次是亞硫酸根。亞硫酸根水解應該得到等量的亞硫酸氫根和氫氧根離子,但是亞硫酸氫根離子還要水解為亞硫酸和氫氧根離子,所以氫氧根離子濃度大于亞硫酸氫根,最后又微量氫離子,所以為:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
④HCN的電離平衡常數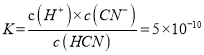 ,若c(CN-)=c(HCN),則
,若c(CN-)=c(HCN),則![]() ,pH=-lg(5×10-10)= 10-lg2 = 9.3。
,pH=-lg(5×10-10)= 10-lg2 = 9.3。
⑤向NaHSO3溶液中加入少量的I2,反應為HSO3- + I2 + H2O = SO42- + 2I- + 3H+,生成的氫離子發生如下反應:HSO3- + H+ = H2SO3,所以c(H2SO3)增大,c(HSO3-)減小,得到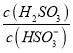 增大。
增大。


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:
【題目】一定條件下,體積為10 L的密閉容器中,1 mol X和1 mol Y進行反應:2X(g)+Y(g) ![]() Z(g),經60 s達到平衡,生成0.3 mol Z。下列說法正確的是
Z(g),經60 s達到平衡,生成0.3 mol Z。下列說法正確的是
A. 若增大壓強,則物質Y的轉化率減小
B. 將容器體積變為20 L,Z的平衡濃度變為原來的![]()
C. 以X的濃度變化表示的反應速率為0.001 mol/(L·s)
D. 若升高溫度,X的體積分數增大,則該反應的ΔH >0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右圖為一種微生物燃料電池結構示意圖,關于該電池敘述正確的是
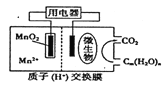
A. 正極反應式為MnO2+4H++2e-===Mn2++2H2O
B. 微生物所在電極區放電時發生還原反應
C. 放電過程中,H+從正極區移向負極區
D. 若用該電池給鉛蓄電池充電,MnO2電極質量減少8.7g,則鉛蓄電池陰極增重9.6g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將HC1氣體通入到1L濃度均為0.1mol/L的NaA和NaB的混合溶液中,混合溶液的pH與離子濃度變化的關系如圖所示(忽略溶液體積的變化)。下列敘述不正確的是
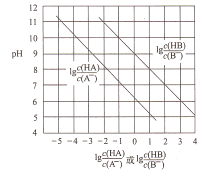
A. Ka(HB)的數量級為10-9
B. 酸性的強弱順序為HCl>HA>HB
C. 當通入0.1molHC1氣體時,c(B-)>c(A-)
D. 當混合溶液呈中性時,c(Na+)=c(Cl-)+c(A-)+c(B-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質中,按單質、化合物、混合物順序排列的是( )
A.鐵、四氧化三鐵、冰水混合物B.氯氣、碳酸鈉、漂白粉
C.水銀、空氣、干冰D.二氧化硫、水蒸氣、鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右表為元素周期表中短周期的一部分,Y元素最高正價與最低負價的代數和為4,下列敘述正確的是
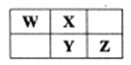
A. 原子半徑: W B. 元素的非金屬性:X>Y>Z
C. 氫化物的熱穩定性:W>X D. 氧化物對應水化物的酸性: Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物與人類生產、生活息息相關。其中尿素(H2NCONH2)是人類最早合成的有機物,工業上生產尿素的反應為: N2+3H2![]() 2NH3,2NH3+CO2
2NH3,2NH3+CO2![]() H2NCONH2+H2O。回答下列問題:
H2NCONH2+H2O。回答下列問題:
(1)納米氧化銅、納米氧化鋅均可作合成氨的催化劑,Cu2+價層電子的軌道表達式為______,Zn位于元素周期表的_______區。
(2)C、N、O三種元素第一電離能從大到小的順序是___________。
(3)上述化學方程式中的無機化合物,沸點由高到低的順序是____________,原因: ___________。
(4)尿素分子中,原子雜化軌道類型有____________,σ鍵與π鍵數目之比為_______。
(5)氮化硼(BN)是一種性能優異、潛力巨大的新型材料,主要結構有立方氮化硼(如圖1)和六方氮化硼(如圖2),前者類似于金剛石,后者與石墨相似。

①晶胞中的原子坐標參數可表亓晶胞內部各原子的相對位置。圖1中原子坐標參數A為(0,0,0),D為(![]() ),則E原子的坐標參數為_____。X-射線衍射實驗測得立方氮化硼晶胞參數為361.5pm,則立方氮化硼晶體N與B的原子半徑之和為______pm。(
),則E原子的坐標參數為_____。X-射線衍射實驗測得立方氮化硼晶胞參數為361.5pm,則立方氮化硼晶體N與B的原子半徑之和為______pm。(![]() )
)
②已知六方氮化硼同層中B-N距離為acm,密度為dg/cm3,則層與層之間距離的計算表達式為_______pm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為常溫下10mL一定物質的量濃度的鹽酸X,用一定物質量濃度的NaOH溶液Y滴定的圖示,據圖推出NaOH溶液和鹽酸的物質的量濃度正確的是( )
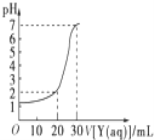
A | B | C | D | |
HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,從A處通入純凈的Cl2,打開B閥時,C處的紅色布條上看不到明顯現象;當關閉B閥后,C處紅布逐漸褪色,則D瓶中裝的是( )

A. 濃H2SO4 B. NaOH溶液 C. Na2SO3溶液 D. 飽和NaCl溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com