
分析 碳酸根離子水解顯堿性,導致鹽堿地產生堿性,水解離子反應為CO32-+H2O?HCO3-+OH-,石膏能與碳酸根離子反應,平衡向左移動,OH-濃度降低,降低堿性,Na2CO3和CaSO4反應生成難溶性的碳酸鈣,同時生成強酸強堿鹽硫酸鈉.
解答 解:碳酸根離子水解顯堿性,導致鹽堿地產生堿性,水解離子反應為CO32-+H2O?HCO3-+OH-,石膏能與碳酸根離子反應,平衡向左移動,OH-濃度降低,降低堿性,石膏電離出的Ca2+與CO32-結合生成更難溶的CaCO3 Na2CO3、CaSO4反應生成難溶性的碳酸鈣,同時生成強酸強堿鹽硫酸鈉,硫酸根離子和鈉離子不水解,則其溶液呈中性,所以石膏能降低其堿性,反應方程式為Na2CO3+CaSO4=Na2SO4+CaCO3↓,
故答案為:Na2CO3+CaSO4=Na2SO4+CaCO3↓.
點評 本題考查了鹽類水解的原理和應用,水解平衡的影響因素判斷,平衡移動方向的分析是解題關鍵,題目較簡單.


 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案 暑假作業(yè)安徽少年兒童出版社系列答案
暑假作業(yè)安徽少年兒童出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氯氣溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 鋁粉投入NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | AlCl3溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
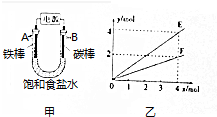
| A. | E表示反應生成NaOH的物質的量 | B. | E表示反應消耗H2O的物質的量 | ||
| C. | F表示反應生成H2或Cl2的物質的量 | D. | F表示反應消耗NaCl的物質的量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化鈉溶解度減小 | B. | 溶液中溶質的質量分數(shù)變小 | ||
| C. | 溶劑的質量減小 | D. | 溶液變成不飽和溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將濕衣服放在太陽下曬干 | B. | 向較多粉塵的地面灑水后再清潔 | ||
| C. | 鐵制欄桿噴涂油漆 | D. | 將食鹽密封好,防止吸潮結塊 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 L H2O含有的分子數(shù)為NA | |
| B. | 常溫常壓下,0.01mol Na2CO3含有的Na+離子數(shù)為 0.02 NA | |
| C. | 通常狀況下,NA 個CO2分子占有的體積為 22.4L | |
| D. | 物質的量濃度為 0.5mol/L 的 MgCl2溶液中,含有Cl- 個數(shù)為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 普通水泥 | B. | 普通玻璃 | C. | 汽車輪胎 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 新制氯水顯酸性,向其中滴加少量紫色石蕊試液,充分振蕩后溶液變紅 | |
| B. | Na2O與Na2O2組成元素相同、陰陽離子個數(shù)比相同,但跟水反應的產物不同 | |
| C. | 只存在共價鍵的物質一定是共價化合物、離子化合物中一定含有離子鍵 | |
| D. | 難溶電解質AB2的飽和溶液中,c(A2+)=xmol•L-1,c(B-)=y mol•L-1,則Ksp值為4xy2 |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com