
汽車尾氣中的NOx是大氣污染物之一,科學家們在嘗試用更科學的方法將NOx轉化成無毒物質,從而減少汽車尾氣污染。
(1)壓縮天然氣(CNG)汽車的優點之一是利用催化技術能夠將NOx轉變成無毒的CO2和N2。
①CH4(g)+4NO2(g) 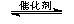 4NO(g)+CO2(g)+2H2O(g)?? △H1<0
4NO(g)+CO2(g)+2H2O(g)?? △H1<0
②CH4(g)+4NO(g) 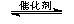 2N2(g)+CO2(g)+2H2O(g)???? △H2<0
2N2(g)+CO2(g)+2H2O(g)???? △H2<0
③CH4(g) +2NO2(g) 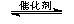 N2(g) +CO2(g) +2H2O(g)? △H3=????????? 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g)? △H3=????????? 。(用△H1和△H2表示)
(2)在恒壓下,將CH4(g)和NO2(g)置于密閉容器中發生化學反應③,在不同溫度、不同投料比時,NO2的平衡轉化率見下表:
投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
1 | 60% | 43% | 28% |
2 | 45% | 33% | 20% |
①寫出該反應平衡常數的表達式K=????????? 。
②若溫度不變,提高[n(NO2) / n(CH4)]投料比,則K將????????? 。(填“增大”、“減小”或“不變”。)
③400 K時,將投料比為1的NO2和CH4的混合氣體共0.04 mol,充入一裝有催化劑的容器中,充分反應后,平衡時NO2的體積分數???????? 。
(3)連續自動監測氮氧化物(NOx)的儀器動態庫侖儀的工作原理示意圖如圖1
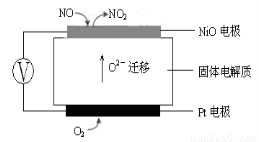

圖1???????????????????????????????????? 圖2
①NiO電極上NO發生的電極反應式:???????????????????????????????? 。
②收集某汽車尾氣經測量NOx的含量為1.12%(體積分數),若用甲烷將其完全轉化為無害氣體,處理1×104L(標準狀況下)該尾氣需要甲烷30g,則尾氣中V(NO)︰V(NO2)=???
(4)在容積相同的兩個密閉容器內 (裝有等量的某種催化劑) 先各通入等量的CH4,然后再分別充入等量的NO和NO2。在不同溫度下,同時分別發生②③兩個反應:并在t秒時測定其中NOx轉化率,繪得圖象如圖2所示:
①從圖中可以得出的結論是
結論一:相同溫度下NO轉化效率比NO2的低
結論二:在250℃-450℃時,NOx轉化率隨溫度升高而增大,450℃-600℃時NOx轉化率隨溫度升高而減小
結論二的原因是????????????????????????????????????????????????????
②在上述NO2和CH4反應中,提高NO2轉化率的措施有_________。(填編號)
A.改用高效催化劑???? B.降低溫度???? C.分離出H2O(g)?????? D.增大壓強
E.增加原催化劑的表面積?? F.減小投料比[n(NO2) / n(CH4)]
(1)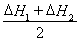 ?? (1分)
?? (1分)
(2)①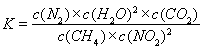 ?? (1分)???? 不變?? (2分)
?? (1分)???? 不變?? (2分)
② 17.4%??????? (2分)
(3)① NO + O2 --2e- = NO2? (2分)
② 1 : 1?????????????????? (2分)
(4)① 原因是:在250℃-450℃時,反應未達到平衡,反應還在正向進行。? (1分)
450℃-600℃時,反應已達平衡,所以,溫度升高平衡逆向移動,NOx轉化率隨溫度升高而減小。(其他合理答案也給分)?? (1分)
② BCF???????? (2分)
【解析】
試題分析:(1)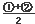 即為目標方程式③,所以,
即為目標方程式③,所以,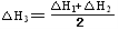
(2)① 該反應的平衡常數的表達式 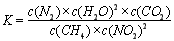
② 平衡常數K不受濃度和壓強的影響,只受溫度的影響,溫度不變K不變。
③ 400 K時,將投料比為1的NO2和CH4的混合氣體共0.04 mol,充入一裝有催化劑的容器中,充分反應后,平衡時NO2的體積分數為:
???????? CH4(g)? +? 2NO2(g)  N2(g) + CO2(g) + 2H2O(g)
N2(g) + CO2(g) + 2H2O(g)
n始???? 0.02??????? 0.02????????? 0??????? 0????????? 0
n轉??? 0.006? 0.02×0.6=0.012?? 0.006??? 0.006????? 0.012
n平??? 0.014?????? 0.008??????? 0.006??? 0.006????? 0.012
0.014 + 0.008 + 0.006 + 0.006 + 0.012 = 0.046
平衡時NO2的體積分數=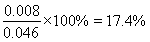
(3)連續自動監測氮氧化物(NOx)的儀器動態庫侖儀實際上就是應用原電池原理,從圖1可知Pt電極(通入O2的一極)為電池的正極,NiO電極(通入NO的一極)為電池的負極,O2 –可以通過固體電解質移向負極。所以,
① NiO電極上NO發生的電極反應式:NO + O2 --2e- = NO2 。
② 1×104L(標準狀況下)尾氣中含NOx的體積為:1×104L×1.12% = 112L,
NOx的物質的量為: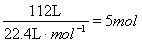 。
。
設NO和NO2的物質的量分別為x、y mol,根據反應化學方程式①和②:
① CH4(g) + 4NO2(g)  4NO(g) + CO2(g)+2H2O(g)????
4NO(g) + CO2(g)+2H2O(g)????
?? 16g??????? 4??????????????? 4
?? m 1???????????? y??????????????? y????? m 1 = 4y
② CH4(g) + 4NO(g)  2N2(g) + CO2(g)+2H2O(g)??
2N2(g) + CO2(g)+2H2O(g)??
16g??????? 4????????
m 2 ????? (x+y)???????????????????? m 2 = 4(x+y)
則: x+y = 5;4(x+y)+ 4y = 30
解得:x =2.5 mol = 2.5 mol
所以,尾氣中V(NO)︰V(NO2) = 1 ︰ 1 。
(4)①從圖2 變化曲線分析,結論二的原因是:在250℃-450℃時,反應未達到平衡,反應還在正向進行;故NOx轉化率隨溫度升高而增大;在在450℃-600℃時反應已達到平衡狀態,因為該反應是放熱反應,此時溫度升高平衡逆向移動,故 NOx轉化率隨溫度升高而減小。
② 由上述NO2和CH4反應的化學方程式的特點分析可知: 該反應是放熱反應;該反應是擴大氣體體積的反應。所以要提高NO2轉化率,可降低溫度,降低溫度能使平衡正向移動,從而提高NO2轉化率;分離出H2O,相當于減小生成物的濃度,使平衡正向移動,從而提高NO2轉化率;減小投料比[n(NO2) / n(CH4)],相當于增加反應物CH4的濃度,使平衡正向移動,從而增大NO2轉化率。而使用催化劑只能改變反應速率,不影響平衡移動,故NO2轉化率不會變化。增大壓強,平衡逆移,NO2轉化率會減小。因此選B C F。
考點:考查化學反應基本理論,涉及氧化還原反應、化學反應速率與化學平衡、化學反應與能量變化、電化學等


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:江蘇省梅村高級中學2012屆高三12月雙周練化學試題 題型:022
某混合動力車,可以用電動機、內燃機或二者結合推動車輪.汽車上坡或加速時,電動機提供推動力,降低了汽油的消耗;在剎車和下坡時電動機處于充電狀態.
(1)混合動力車的內燃機以汽油為燃料,汽油(以辛烷C8H18計)和氧氣充分反應,每生成1 mol水蒸氣放熱569.1 kJ.則該反應的熱化學方程式為________.
(2)混合動力車的電動機目前一般使用的是鎳氫電池,鎳氫電池采用鎳的化合物為正極,儲氫金屬(以M表示)為負極,堿液(主要為KOH)為電解液.鎳氫電池充放電原理示意如圖,其總反應式是:
 H2+2NiOOH
H2+2NiOOH根據所給信息判斷,混合動力車上坡或加速時,乙電極周圍溶液的pH將________(填“增大”、“不變”或“減小”),該電極的電極反應式為________.
(3)汽車尾氣中的一氧化碳是大氣污染物,可通過如下反應降低其濃度:CO(g)+1/2O2(g)![]() CO2(g).
CO2(g).
①某溫度下,在兩個容器中進行上述反應,容器中各物質的起始濃度及正逆反應速率關系如下表所示.請填寫表中的空格.

②相同溫度下,某汽車尾氣中CO、CO2的濃度分別為1.0×10-5 mol·L-1和1.0×10-4mol·L-1.若在汽車的排氣管上增加一個補燃器,不斷補充O2并使其濃度保持為1.0×10-4 mol·L-1,則最終尾氣中CO的濃度為________mol·L-1.
(4)汽車尾氣中的NOx是另一種大氣污染物,可用NH3在催化劑存在下凈化,寫出該反應的化學方程式________.當參加反應的NH3在標準狀況下體積為a L時,還原產物的質量為________g
查看答案和解析>>
科目:高中化學 來源: 題型:
下列敘述錯誤的是( )
A.汽車尾氣中的NOx是造成光化學煙霧的唯一因素
B.空氣中SO2、NOx等是形成酸雨的重要原因
C.冬天撒鹽融雪能造成土壤和水污染
D.河流入海口處形成的三角洲是海水使河水泥沙膠體凝聚的結果
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com