
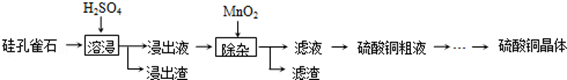
分析 硅孔雀石加硫酸溶浸,發生的反應為:CuSiO3•2H2O+H2SO4=CuSO4+H2SiO3+2H2O,FeCO3、Fe2O3與硫酸反應生成二價鐵和三價鐵離子,則浸出液中含有二價銅、二價鐵和三價鐵離子,再加二氧化錳,將二價鐵氧化成三價鐵離子,進一步除雜最終得到硫酸銅晶體,
(1)“溶浸”中CuSiO3•2H2O和H2SO4發生生成硫酸銅、硅酸和水;
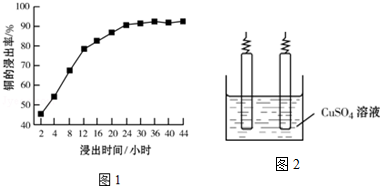
(2)根據圖象分析,隨著浸出時間的增長,①銅的浸出率相應增加;②浸出時間超過24小時后,銅的浸出率變化不是很明顯;
(3)根據實驗目的除去鐵,則二氧化錳將二價鐵氧化成三價鐵;根據pH到3~4Fe3+完全沉淀分析;
(4)根據反應化合價降低的為氧化劑判斷;
(5)電解精煉銅時,粗銅應該放在陽極,精銅為陰極,發生還原反應 Cu2++2e-=Cu,電解質溶液為硫酸銅溶液.
解答 解:硅孔雀石加硫酸溶浸,發生的反應為:CuSiO3•2H2O+H2SO4=CuSO4+H2SiO3+2H2O,FeCO3、Fe2O3與硫酸反應生成二價鐵和三價鐵離子,則浸出液中含有二價銅、二價鐵和三價鐵離子,再加二氧化錳,將二價鐵氧化成三價鐵離子,進一步除雜最終得到硫酸銅晶體,
(1)“溶浸”中CuSiO3•2H2O和H2SO4發生生成硫酸銅、硅酸和水,方程式為:CuSiO3•2H2O+H2SO4=CuSO4+H2SiO3+2H2O,
故答案為:CuSiO3•2H2O+H2SO4=CuSO4+H2SiO3+2H2O;
(2)根據圖象變化趨勢,隨著浸出時間的增長,①銅的浸出率相應增加;②浸出時間超過24小時后,銅的浸出率變化不是很明顯,
故答案為:①銅的浸出率相應增加;②浸出時間超過24小時后,銅的浸出率變化不是很明顯;
(3)因為要將鐵轉化成氫氧化鐵除去,則二氧化錳將二價鐵氧化成三價鐵,離子方程式為:2Fe2++MnO2+4H+=2Fe3++2H2O+Mn2+;pH到3~4只有Fe3+完全沉淀,所以濾渣的主要成分為氫氧化鐵,
故答案為:2Fe2++MnO2+4H+=2Fe3++2H2O+Mn2+;Fe(OH)3;
(4)Cu2S+2Cu2O $\frac{\underline{\;高溫\;}}{\;}$6Cu+SO2↑,化合價發生降低有Cu2O、Cu2S,所以氧化劑為:Cu2O、Cu2S,
故答案為:Cu2O、Cu2S;
(5)電解精煉銅時,粗銅應該放在陽極,精銅為陰極,發生還原反應 Cu2++2e-=Cu,電解質溶液為硫酸銅溶液,
故答案為:Cu2++2e-=Cu;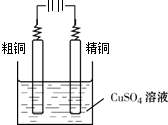 .
.
點評 本題考查銅及其化合物的性質,主要是流程分析,產物判斷,電解池原理的應用,特別是閱讀信息、處理信息的能力,難度稍大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 該分散系的分散質為Fe2O3 | |
| B. | 可用過濾的方法將黑色金屬氧化物與Na分離開 | |
| C. | 在電場作用下,陰極附近分散系黑色變深,則說明該分散系帶正電荷 | |
| D. | 當光束通過該分散系時,可以看到一條光亮的“通路” |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某化學課外小組用右圖裝置制取溴苯并探究該反應的類型.先向分液漏斗中加入苯和液溴,再將混合液滴入反應器A(A下端活塞關閉)中.
某化學課外小組用右圖裝置制取溴苯并探究該反應的類型.先向分液漏斗中加入苯和液溴,再將混合液滴入反應器A(A下端活塞關閉)中. .
.| 向試管D中加入的試劑 | 能證明苯與液溴發生取代反應的現象 | |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
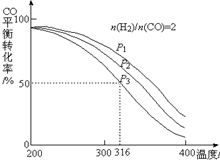 利用CO和H2還可以制備二甲醚.將合成氣以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反應器中,一定條件下發生反應:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡轉化率隨溫度、壓強變化關系如右圖所示,下列說法不正確的是B.
利用CO和H2還可以制備二甲醚.將合成氣以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反應器中,一定條件下發生反應:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡轉化率隨溫度、壓強變化關系如右圖所示,下列說法不正確的是B.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

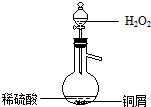 (3)某同學查詢資料得知:銅屑放入稀硫酸中不發生反應,若在稀硫酸中加入H2O2,銅屑可逐漸溶解.實驗小組同學設計實驗裝置如圖,驗證該實驗,該反應的化學方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.
(3)某同學查詢資料得知:銅屑放入稀硫酸中不發生反應,若在稀硫酸中加入H2O2,銅屑可逐漸溶解.實驗小組同學設計實驗裝置如圖,驗證該實驗,該反應的化學方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ,并寫出元素b的單質在二氧化碳中燃燒的化學方程式:2Mg+CO2$\frac{\underline{\;點燃\;}}{\;}$2MgO+C
,并寫出元素b的單質在二氧化碳中燃燒的化學方程式:2Mg+CO2$\frac{\underline{\;點燃\;}}{\;}$2MgO+C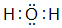 ,寫出f元素單質與該氫化物反應的離子方程式:Cl2+H2O=H++Cl-+HClO.
,寫出f元素單質與該氫化物反應的離子方程式:Cl2+H2O=H++Cl-+HClO.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com