
【題目】把煤作為燃料可通過下列兩種途徑:
途徑Ⅰ C(s) + O2(g) = CO2(g);ΔH = -393.15 kJ·mol-1 ①
途徑Ⅱ 先制成水煤氣:
C(s) + H2O(g) = CO(g) + H2(g); ΔH2 ②
再燃料水煤氣:
2CO(g) + O2(g) = 2CO2(g); ΔH= -566kJ·mol-1 ③
2H2(g) + O2(g) = 2H2O(g);ΔH= -484 kJ·mol-1 ④
請回答下列問題:
(1)途徑Ⅰ放出的熱量理論上_________(填“大于”“等于”或“小于”)途徑Ⅱ放出的熱量。
(2)ΔH2=_______________。
(3)煤燃燒的煙氣(主要污染物SO2、NOx)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中SO2、NOx的含量。O3氧化煙氣中SO2、NOx的主要反應的熱化學方程式為
NO(g)+O3(g)==NO2(g)+O2(g) ΔH=-200.9kJ·mol-1
NO(g)+![]() O2(g)==NO2(g) ΔH=-58.2kJ·mol-1
O2(g)==NO2(g) ΔH=-58.2kJ·mol-1
SO2(g)+O3(g)==SO3(g)+O2(g) ΔH=-241.6kJ·mol-1
反應3NO(g)+O3(g)==3NO2(g)的ΔH=________kJ·mol-1。
(4)已知下列各組熱化學方程式
① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H=-25kJ/mol
② 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640kJ/mol
請寫出FeO(s)被CO(g)還原成Fe和CO2(g)的熱化學方程式______________________________。
(5)在標準狀況下的11.2L甲烷完全燃燒生成CO2 和液態水放出444.8kJ熱量(298K),其燃燒熱的熱化學方程式______________________________________________________; 已知斷裂下列1mol化學鍵需要吸收的能量分別為:C=O:745kJ/mol , O=O:496kJ/mol , C-H:414kJ/mol 則斷裂1molH-O鍵需要提供的能量為____________________ kJ。
【答案】 等于 +131.85 kJ/mol -317.3 FeO(s)+CO(g)=Fe(s)+CO2(g) △H=-218 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-889.6 kJ/mol 511.9 kJ
【解析】(1)根據蓋斯定律,反應熱只與始態與終態有關,與途徑無關,途徑Ⅰ與途徑Ⅱ的始態相同、終態相同反應熱相等;(2)已知:①C(s) + O2(g) = CO2(g);ΔH1 = -393.15 kJ·mol-1;③2CO(g) + O2(g) = 2CO2(g); ΔH3= -566kJ·mol-1 ;④2H2(g) + O2(g) = 2H2O(g);ΔH4= -484 kJ·mol-1;根據蓋斯定律,由①-![]() ×③-
×③-![]() ×④可得反應②C(s) + H2O(g) = CO(g) + H2(g),則ΔH2=ΔH1-
×④可得反應②C(s) + H2O(g) = CO(g) + H2(g),則ΔH2=ΔH1-![]() ΔH3-
ΔH3-![]() ΔH4=-393.15 kJ·mol-1-
ΔH4=-393.15 kJ·mol-1-![]() ×(-566kJ·mol-1)-
×(-566kJ·mol-1)-![]() ×(-484 kJ·mol-1)=+131.85 kJ/mol;(3)已知:①NO(g)+O3(g)==NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1;②NO(g)+
×(-484 kJ·mol-1)=+131.85 kJ/mol;(3)已知:①NO(g)+O3(g)==NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1;②NO(g)+![]() O2(g)==NO2(g) ΔH2=-58.2kJ·mol-1;③SO2(g)+O3(g)==SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1;根據蓋斯定律,由①-2×②可得反應3NO(g)+O3(g)==3NO2(g),則ΔH=ΔH1+2×ΔH2=-200.9kJ·mol-1+2×(-58.2kJ·mol-1)=-317.3 kJ/mol;(4)已知① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H1=-25kJ/mol;② 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-47kJ/mol;③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=+640kJ/mol;根據蓋斯定律,由-
O2(g)==NO2(g) ΔH2=-58.2kJ·mol-1;③SO2(g)+O3(g)==SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1;根據蓋斯定律,由①-2×②可得反應3NO(g)+O3(g)==3NO2(g),則ΔH=ΔH1+2×ΔH2=-200.9kJ·mol-1+2×(-58.2kJ·mol-1)=-317.3 kJ/mol;(4)已知① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H1=-25kJ/mol;② 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-47kJ/mol;③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=+640kJ/mol;根據蓋斯定律,由-![]() -
-![]() ×②+
×②+![]() ×①可得反應FeO(s)+CO(g)=Fe(s)+CO2(g) ,則△H=-
×①可得反應FeO(s)+CO(g)=Fe(s)+CO2(g) ,則△H=-![]() ×△H2+
×△H2+![]() ×△H1=-218 kJ/mol;(5)在標準狀況下的11.2L甲烷完全燃燒生成CO2 和液態水放出444.8kJ熱量(298K,甲烷的物質的量是n(CH4)=
×△H1=-218 kJ/mol;(5)在標準狀況下的11.2L甲烷完全燃燒生成CO2 和液態水放出444.8kJ熱量(298K,甲烷的物質的量是n(CH4)= ![]() =0.5mol,所以甲烷完全燃燒生成CO2 和液態水的熱化學方程式為CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= —889.6kJ/mol;斷裂下列1mol化學鍵需要吸收的能量分別為:C=O:745kJ/mol, O=O:496kJ/mol ,C-H:414kJ/mol ,反應熱是斷裂反應物的化學鍵吸收的熱量與產生生成物的化學鍵所釋放的熱量的差,則4×414kJ/mol+2mol×496kJ/mol-2mol×745kJ/mol -4×H-O=—889.6kJ。解得H-O的鍵能是511.9kJ/mol,斷裂1molH-O鍵需要提供的能量為511.9kJ。
=0.5mol,所以甲烷完全燃燒生成CO2 和液態水的熱化學方程式為CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= —889.6kJ/mol;斷裂下列1mol化學鍵需要吸收的能量分別為:C=O:745kJ/mol, O=O:496kJ/mol ,C-H:414kJ/mol ,反應熱是斷裂反應物的化學鍵吸收的熱量與產生生成物的化學鍵所釋放的熱量的差,則4×414kJ/mol+2mol×496kJ/mol-2mol×745kJ/mol -4×H-O=—889.6kJ。解得H-O的鍵能是511.9kJ/mol,斷裂1molH-O鍵需要提供的能量為511.9kJ。


 周周清檢測系列答案
周周清檢測系列答案 輕巧奪冠周測月考直通高考系列答案
輕巧奪冠周測月考直通高考系列答案科目:高中化學 來源: 題型:
【題目】化學與生活、環境密切相關,下列說法錯誤的是
A. 做油條用的膨松劑不應含明礬
B. 享有“鎮國之寶”稱謂的“后母戊鼎”屬于青銅制品
C. 汽車尾氣中含有的氮氧化物,是汽油不完全燃燒造成的
D. “煤改氣”可以減少SO2等有害物質的排放量,有利于“霧霾”天氣的治理
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】自然界氮的循環過程如圖.回答下列問題。
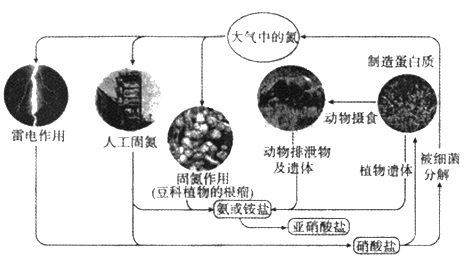
(1)上圖中包含了_____種氮的固定方式,寫出屬于雷電作用固氮的化學方程式________。
(2)合成氮反應常用鐵觸媒催化劑,下列關于催化劑的說法不正確的是______。
A.可以加快反應速率 B.可以改變反應熱
C.可以減少反應中的能耗 D.可以增加活化分子的數目
(3)氮的循環中,亞硝酸鹽是重要的一環,利用化合價可推知亞硝酸鹽具有_____性和_____性,亞硝酸鹽和酸性高錳酸鉀反應的離子方程式為__________________。
(4)某同學加熱Fe(NO3)2時,發現得到了紅色固體和紅色氣體,且所得氣體被水充分吸收后體積少于原體積的l/3,Fe(NO3)2熱分解的化學方程式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中所描述的物質一定是金屬元素的是( )
A. 易失去電子的物質
B. 原子最外電子層只有一個電子的元素
C. 單質具有金屬光澤的元素
D. 原子的最外電子層只有2個電子且核外電子總數大于3的元素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中,正確的是
A. 兩種微粒,若核外電子排布完全相同,則其化學性質一定相同
B. 凡單原子形成的離子,一定具有稀有氣體元素原子的核外電子排布
C. 兩原子的核外電子排布相同,則一定屬于同種元素
D. 一種陽離子和一種陰離子的質子數和電子數可能同時相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于維生素的敘述中,不正確的是
A. 維生素是參與生物發育和新陳代謝所必需的一類小分子
B. 人體對維生素的需要量極小,但對人體的生長和健康至關重要
C. 為保證青少年的健康成長,應大量補充維生素
D. 習慣上把維生素分為脂溶性維生素和水溶性維生素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A,B,C,D四塊金屬片,進行如下實驗: ①A、B用導線相連后,同時浸入稀H2SO4溶液中,A極為負極; ②C、D用導線相連后,同時浸入稀H2SO4溶液中,電流由C經導線流向D; ③A、C相連后,同時浸入CuSO4溶液中,C極質量增加; ④B、D相連后,同時浸入CuSO4溶液中,Cu2+移向D極被還原。據此,判斷四種金屬的活動性順序是( )
A.A>B>D>CB.A>C>D>BC.C>A>B>DD.B>D>C>A
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO2、SO2 、CO等大氣污染氣體的處理具有重要意義。
(1)NO2可用水吸收,相應的化學反應方程式為__________________。
利用反應6NO2+8NH3 ![]() 7N2+12H2O也可處理NO2。當轉移1.2mol電子時,消耗的NO2在標準狀況下是_________ L。
7N2+12H2O也可處理NO2。當轉移1.2mol電子時,消耗的NO2在標準狀況下是_________ L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=﹣196.6 kJ·mol-1
2SO3(g) ΔH=﹣196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=﹣113.0 kJ·mol-1
2NO2(g) ΔH=﹣113.0 kJ·mol-1
則反應NO2(g)+SO2(g)![]() SO3(g)+NO(g) 的ΔH=__________kJ·mol-1。
SO3(g)+NO(g) 的ΔH=__________kJ·mol-1。
一定條件下,將NO2與SO2以體積比1:2置于一恒容密閉絕熱容器中發生上述反應,下列能說明反應達到平衡狀態的是________。
a.體系壓強保持不變 b.混合氣體顏色保持不變
c.SO3和NO的體積比保持不變 d.每消耗1 mol SO3的同時生成1 mol NO2
(3)CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣a kJ·mol-1。
CH3OH(g) ΔH=﹣a kJ·mol-1。
在一定溫度下,將1mol CO(g)和2molH2(g)充入到體積為10L的密閉容器中,發生反應。經過5min達到平衡,此時容器內壓強為反應前的0.8倍。則此時v逆(CH3OH)為_____,正反應放出的熱量為__________________。
(4)已知N2O4(g) ![]() 2NO2(g) ΔH>0,現將1molN2O4充入一恒壓密閉容器中,下列示意圖不能說明反應達到平衡狀態的是________。
2NO2(g) ΔH>0,現將1molN2O4充入一恒壓密閉容器中,下列示意圖不能說明反應達到平衡狀態的是________。



查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com