
| 溫度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
 ).
).
| ||
| △t |
| c(CO) |
| c(CO2) |
| x |
| 4-x |
| 2mol |
| 4mol |
| ||
| 10min |
| c(CO) |
| c(CO2) |


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
| 溫度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
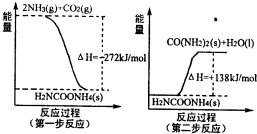
| 溫度/ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
2- 3 |
- 3 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
- 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
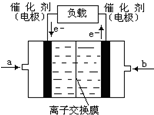
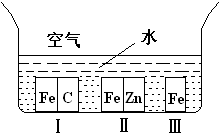 A、【供選學《化學與生活》考生作答】
A、【供選學《化學與生活》考生作答】| 溫度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、升高溫度該反應的正反應速率增大,逆反應速率減小 | ||
B、該反應的化學平衡常數表達式為K=
| ||
| C、絕熱容器中進行該反應,溫度不再變化,則達到化學平衡狀態 | ||
| D、該反應的正反應是放熱反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com