
【題目】設NA為阿伏加德羅常數的值,下列說法不正確的是( )
A.將1mol氯化鐵完全溶于水制成膠體,其中所含膠體粒子數目小于NA
B.標準狀況下22.4 L HF中含有的氟原子數目為NA
C.常溫下,2.8g C2H4與C3H6的混合物中共價鍵數為0.6NA
D.1L含NA個Al3+的Al(NO3)3液中,NO3-物質的量濃度大于3 mol/L
【答案】B
【解析】
A. 氫氧化鐵膠粒為多個氫氧化鐵的聚集體,故1mol氯化鐵形成的膠粒的個數小于NA個,故A正確;
B. 標準狀況下,HF不是氣態,22.4L不是1mol,氟原子數目不是NA,故B不正確;
C.C2H4和C3H6中,每個C原子平均形成了1個碳碳鍵、每個H原子平均形成了1個碳氫鍵,2.8g的C2H4和C3H6的混合物中含有2.8![]() 14=0.2molCH2,含0.2mol碳碳鍵、0.4mol碳氫鍵,所以共價鍵數為0.6NA個,故C正確;
14=0.2molCH2,含0.2mol碳碳鍵、0.4mol碳氫鍵,所以共價鍵數為0.6NA個,故C正確;
D.Al3+是弱堿陽離子,在溶液中會水解,故當含NA個Al3+時,溶液NO3-物質的量大于3 mol,其濃度大于3mol/L,故D正確;
故選B。


科目:高中化學 來源: 題型:
【題目】在一定條件下的定容密閉容器中,發生反應2SO2(g)+ O2(g) ![]() 2SO3(g), 下列哪種情況,能表明反應達到平衡狀態
2SO3(g), 下列哪種情況,能表明反應達到平衡狀態
A. SO3的體積百分含量保持不變
B. SO2速率是O2速率的2倍
C. SO3的濃度是O2濃度的2倍
D. 單位時間內SO2消耗的濃度等于SO3生成的濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個容積為2 L的密閉容器中,加入0.8 mol的A2氣體和0.6 mol B2氣體,一定條件下發生如下反應:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反應中各物質的濃度隨時間的變化情況如圖所示,下列說法不正確的是
2AB(g) ΔH<0,反應中各物質的濃度隨時間的變化情況如圖所示,下列說法不正確的是

A. 圖中a點的值為0.15 B. 該反應的平衡常數K=0.03
C. 溫度升高,平衡常數K值減小 D. 平衡時A2的轉化率為62.5%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化鋯(ZrO2)材料具有高硬度、高熔點、高強度、高韌性、極高的耐磨性及耐化學腐蝕性等優良的物化性能。以鋯英石(主要成分為 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等雜質)為原料通過堿熔法制備氧化鋯(ZrO2)的流程如下:
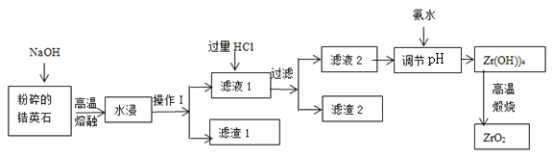
25℃時,有關離子在水溶液中沉淀時的pH數據:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
開始沉淀時pH | 1.9 | 2.2 | 3.4 |
沉淀完全時pH | 3.2 | 3.2 | 4.7 |
請回答下列問題:
(1)流程中旨在提高化學反應速率的措施有________________________________。
(2)操作I的名稱是__________________,濾渣1成分為_________,濾渣2的成分為_____________。
(3)鋯英石經“高溫熔融”轉化為Na2ZrO3,寫出該反應的化學方程式:____________________。
(4)“調節pH”時,合適的pH范圍是__________________。為了得到純的ZrO2,Zr(OH)4需要洗滌,檢驗Zr(OH)4是否洗滌干凈的方法是__________________。
(5)寫出“高溫煅燒”過程的化學方程式________________________________。根據ZrO2的性質,推測其一種用途________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種微生物燃料電池的結構示意圖如下所示,關于該電池的敘述正確的是( )
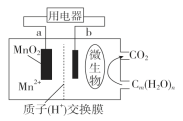
A. 電池工作時,電子由a流向b
B. 微生物所在電極區放電時發生還原反應
C. 放電過程中,H+從正極區移向負極區
D. 正極反應式為:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原子團SCN化合價為-1價,在很多方面跟鹵素原子相似,因此稱為“擬鹵素”。擬鹵素離子與鹵離子還原性強弱順序為Cl-<Br-<SCN-<I-,又知氧化性I2>S,下列反應不正確的是( )
A. (SCN)2+2Br-=Br2+2SCN-
B. (SCN)2+H2S=2H++2SCN-+S↓
C. 4H++2SCN-+MnO2![]() Mn2++(SCN)2↑+2H2O
Mn2++(SCN)2↑+2H2O
D. (SCN)2+2I-=2SCN-+I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應Fe+H2SO4![]() FeSO4+H2↑的能量變化趨勢如圖所示:
FeSO4+H2↑的能量變化趨勢如圖所示:
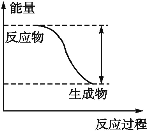
(1)該反應為____________(填“吸熱”或“放熱”)反應。
(2)若要使該反應的反應速率增大,下列措施可行的是____________(填字母)。
A.改鐵片為鐵粉B.改稀硫酸為98%的濃硫酸C.升高溫度D.減小壓強
(3)若將上述反應設計成原電池,銅為原電池某一極材料,則銅為____________(填“正”或“負”)極。銅片上產生的現象為____________,該極上發生的電極反應為____________,鐵電極的電極反應為____________,外電路中電子由____________(填“正”或“負”,下同)極向____________極移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究金屬與硝酸的反應,實驗如下。

(1)Ⅰ中的無色氣體是_________。
(2)Ⅱ中生成H2的離子方程式是______________________________________。
(3)研究Ⅱ中的氧化劑
①甲同學認為該濃度的硝酸中H+的氧化性大于NO3-,所以NO3-沒有發生反應。乙同學依據Ⅰ和Ⅱ證明了甲的說法不正確,其實驗證據是_______________________________。
②乙同學通過分析,推測出NO3-也能被還原,依據是___________________________,進而他通過實驗證實該溶液中含有NH4+,其實驗操作是__________________________
(4)根據實驗,金屬與硝酸反應時,影響硝酸還原產物不同的因素有_________________________試推測還可能有哪些因素影響_________(列舉1條)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)H2O的相對分子質量是______;1 molH2O質量是______克;1.5 mol H2O的質量為_____;H2O的摩爾質量是_____。
(2)3.01×1022個OH-的物質的量為____mol,質量為___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com