
分析 (1)由質量守恒可知,C的質量為16g+20g-30g=6g,結合M=$\frac{m}{n}$計算;
(2)結合m=nM計算及分子構成計算;
(3)結合n=$\frac{m}{M}$、n=$\frac{V}{Vm}$計算;
(4)結合n=$\frac{N}{{N}_{A}}$、V=nVm、m=nM計算;
(5)硫酸銨、氫氧化鋇均為強電解質,完全電離,遵循電荷、原子守恒.
解答 解:(1)由質量守恒可知,C的質量為16g+20g-30g=6g,C的摩爾質量為$\frac{6g}{0.05mol}$=120g•mol-1,故答案為:120g•mol-1;
(2)由0.3mol×17g/mol≠0.4mol×44g/mol,原子的物質的量為0.3mol×4=0.4mol×3,可知二者質量不相等,原子數相等,故答案為:不相等;相等;
(3)二者的物質的量分別為$\frac{4g}{2g/mol}$=2mol、$\frac{22.4L}{22.4L/mol}$=1mol,則所含分子數目較多的是H2,故答案為:H2;
(4)3.01×1023個CO2分子中含$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$×2=1mol氧原子,在標準狀況下其體積為$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$×22.4L/mol=11.2L,它與1mol×18g/mol=18g H2O含有相同的氧原子數,
故答案為:1;11.2; 18;
(5)電離方程式分別為(NH4)2SO4=2NH4++SO42-、Ba(OH)2=Ba2++2OH-,故答案為:(NH4)2SO4=2NH4++SO42-;Ba(OH)2=Ba2++2OH-.
點評 本題考查物質的量的計算,為高頻考點,把握質量、體積、物質的量關系為解答的關鍵,側重分析與計算能力的考查,注意物質的構成及基本計算公式的應用,題目難度不大.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
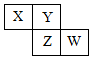 X、Y、Z、W均為短周期元素,它們在元素周期表中相對位置如圖所示,若Z原子的最外層電子數是第一層電子數的3倍,下列說法正確的是( )
X、Y、Z、W均為短周期元素,它們在元素周期表中相對位置如圖所示,若Z原子的最外層電子數是第一層電子數的3倍,下列說法正確的是( )| A. | Y單質與氫氣反應較Z劇烈 | |
| B. | 最高價氧化物對應水化物酸性W比Z弱 | |
| C. | X單質氧化性強于Y單質 | |
| D. | X與W的原子核外電子數相差9 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 當溫度一定時,不同的起始條件下可逆反應建立平衡狀態時,平衡常數和轉化率一定是定值 | |
| B. | 依據焓判據:NH4HCO3受熱分解可自發進行 | |
| C. | 大多數化學反應在一定條件下都有一定的限度 | |
| D. | FeCl3與KSCN反應達到平衡時,向其中滴加少量KCl溶液,則溶液顏色變深 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | 化學變化 | 物理變化 |
| B | 氧化還原反應 | 分解反應 |
| C | 氧化還原反應 | 化合反應 |
| D | 中和反應 | 復分解反應 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 200mL 2 mol/LMgCl2溶液 | B. | 1000mL 2.5 mol/L NaCl溶液 | ||
| C. | 300mL 5 mol/L KCl溶液 | D. | 250mL 1 mol/L FeCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com