
 汽車尾氣、燃煤尾氣、地面灰塵等污染物是造成空氣污染的主要原因.
汽車尾氣、燃煤尾氣、地面灰塵等污染物是造成空氣污染的主要原因.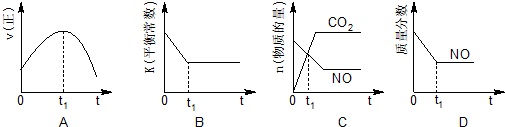
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡 所需時間/min | ||
| CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
| 1 | 650 | 2 | 1 | 0.4 | 1.6 | 6 |
| 2 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
分析 (1)①根據(jù)到達平衡的時間判斷溫度高低,根據(jù)平衡時二氧化碳的濃度判斷溫度對平衡的影響;
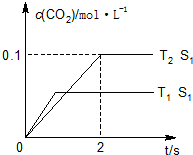
②由圖可知,T2溫度平衡時,二氧化碳的濃度變化量為0.1mol/L,根據(jù)v=$\frac{△c}{t}$計算v(CO2),再根據(jù)速率之比等于化學(xué)計量數(shù)之比計算v(N2);
③接觸面積越大反應(yīng)速率越快,到達平衡的時間越短,催化劑的表面積S1>S2,S2條件下達到平衡所用時間更長,但催化劑不影響平衡移動,平衡時二氧化碳的濃度與溫度T1到達平衡時相同;
④A.到達平衡后正、逆速率相等,不再變化;
B.到達平衡后,溫度為定值,平衡常數(shù)不變,結(jié)合反應(yīng)熱判斷隨反應(yīng)進行容器內(nèi)溫度變化,判斷溫度對化學(xué)平衡常數(shù)的影響;
C.t1時刻后二氧化碳、NO的物質(zhì)的量發(fā)生變化,最后不再變化;
D.到達平衡后各組分的含量不發(fā)生變化;
(2)根據(jù)蓋斯定律,由已知熱化學(xué)方程式乘以適當(dāng)?shù)南禂?shù)進行加減構(gòu)造目標(biāo)熱化學(xué)方程式;
(3)①利用三段式計算平衡時,各組分的物質(zhì)的量,該反應(yīng)是氣體體積不變的反應(yīng),故利用物質(zhì)的量代替濃度代入平衡常數(shù)表達式計算平衡常數(shù);
②第二組溫度比第一組高,反應(yīng)物物質(zhì)的量比第一組增大一倍,平衡時CO2的物質(zhì)的量比第一組的多,表明該反應(yīng)為吸熱反應(yīng).
解答 解:(1)①由圖1可知,溫度T1先到達平衡,故溫度T1>T2,溫度越高平衡時,二氧化碳的濃度越低,說明升高溫度平衡向逆反應(yīng)移動,故正反應(yīng)為放熱反應(yīng),
故答案為:<;
②由圖可知,T2溫度時2s到達平衡,平衡時二氧化碳的濃度變化量為0.1mol/L,故v(CO2)=$\frac{0.1mol/L}{2s}$0.05mol/(L•s),速率之比等于化學(xué)計量數(shù)之比,故v(N2)=0.5v(CO2)=0.5×0.05mol/(L•s)=0.025mol/(L•s),
故答案為:0.025mol/(L•s);
③接觸面積越大反應(yīng)速率越快,到達平衡的時間越短,催化劑的表面積S1>S2,S2條件下達到平衡所用時間更長,但催化劑不影響平衡移動,平衡時二氧化碳的濃度與溫度T1到達平衡時相同,故c(CO2)在T1、S2條件下達到平衡過程中的變化曲線為: ,
,
故答案為: ;
;
④A.到達平衡后正、逆速率相等,不再變化,t1時刻V正最大,之后隨反應(yīng)進行速率發(fā)生變化,未到達平衡,故A錯誤;
B.該反應(yīng)正反應(yīng)為放熱反應(yīng),隨反應(yīng)進行溫度升高,化學(xué)平衡常數(shù)減小,到達平衡后,溫度為定值,達最高,平衡常數(shù)不變,故B正確,
C、t1時刻后二氧化碳、NO的物質(zhì)的量發(fā)生變化,t1時刻未到達平衡狀態(tài),故C錯誤;
D、NO的質(zhì)量分數(shù)為定值,t1時刻處于平衡狀態(tài),故D正確;
故答案為:BD;
(2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol①
2NO2(g)?N2O4(g)△H2=-56.9kJ/mol②
H2O(g)=H2O(l)△H=-44.0kJ/mol③
根據(jù)蓋斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol,
故答案為:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol;
(3)①平衡時CO2的物質(zhì)的量為1.6mol,則:
CO(g)+H2O(g)?CO2(g)+H2(g),
開始(mol):2 1 0 0
變化(mol):0.6 0.6 1.6 1.6
平衡(mol):1.4 0.4 1.6 1.6
該反應(yīng)前后氣體體積不變,故利用物質(zhì)的量代替濃度計算平衡常數(shù),故650℃時該反應(yīng)平衡常數(shù)k=$\frac{1.6×1.6}{1.4×0.4}$=4.57,
故答案為:4.57;
②實驗1中CO2的轉(zhuǎn)化率為$\frac{2-1.6}{2}$×100%=20%,實驗2中CO2的轉(zhuǎn)化率為$\frac{4-2.4}{4}$×100%=40%,則實驗1的轉(zhuǎn)化率小于實驗2,則說明溫度升高平衡向正反應(yīng)方向移動,正反應(yīng)吸熱,故答案為:>.
點評 本題考查化學(xué)平衡圖象、化學(xué)反應(yīng)速率、影響化學(xué)平衡的因素、平衡常數(shù)計算等,題目綜合性較大,較難,是對知識的綜合利用、注意基礎(chǔ)知識的理解掌握.


 快捷英語周周練系列答案
快捷英語周周練系列答案科目:高中化學(xué) 來源: 題型:解答題
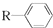 $→_{一定條件}^{CO、HCl}$
$→_{一定條件}^{CO、HCl}$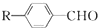 ,為合成某種液晶材料的中間體M,有人提出如下不同的合成途徑:
,為合成某種液晶材料的中間體M,有人提出如下不同的合成途徑: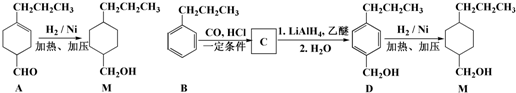
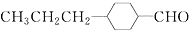 和
和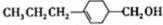 (寫結(jié)構(gòu)簡式)生成.
(寫結(jié)構(gòu)簡式)生成.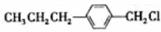 .
.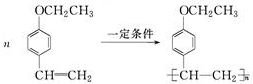 .
.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
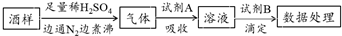
| A. | 葡萄酒中加亞硫酸鹽的主要目的是防止氧化,利用了亞硫酸鹽的還原性 | |
| B. | 通入N2和煮沸的目的是為了將產(chǎn)生的氣體從溶液中全部趕出 | |
| C. | 若試劑A選擇氯水,則試劑B可選擇NaOH標(biāo)準(zhǔn)液 | |
| D. | 若試劑A選擇堿液,調(diào)節(jié)吸收后溶液為中性,則試劑B可選擇I2標(biāo)準(zhǔn)液 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
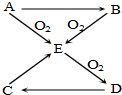 已知A、B、C、D、E五種物質(zhì)有如圖所示的轉(zhuǎn)化關(guān)系(部分反應(yīng)物及反應(yīng)條件未列出,若解題時需要,可作合理假設(shè)),且五種物質(zhì)中均含有A元素.
已知A、B、C、D、E五種物質(zhì)有如圖所示的轉(zhuǎn)化關(guān)系(部分反應(yīng)物及反應(yīng)條件未列出,若解題時需要,可作合理假設(shè)),且五種物質(zhì)中均含有A元素.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | CH3OCH3 | B. | CH3CH2OH | C. | CH3CH2CH3 | D. | CH3COCH2CH3 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
| 實 驗 步 驟 | 實 驗 結(jié) 論 |
| (1)將9.0g A在足量純O2中充分燃燒,并使其產(chǎn)物依次緩緩?fù)ㄟ^足量的濃硫酸和堿石灰,發(fā)現(xiàn)兩者分別增重5.4g和13.2g. | (1)A的實驗式為CH2O. |
| (2)通過質(zhì)譜法測得其相對分子質(zhì)量為90. | (2)A的分子式為C3H6O3. |
| (3)另取9.0g A,跟足量的NaHCO3粉末反應(yīng),生成2.24L CO2(標(biāo)準(zhǔn)狀況),若與足量金屬鈉反應(yīng)則生成2.24L H2(標(biāo)準(zhǔn)狀況). | (3)A中含有的官能團名稱為羧基、羥基. |
| (4)A的核磁共振氫譜有四組吸收峰,其峰面積之比為2:2:1:1. | (4)綜上所述,A的結(jié)構(gòu)簡式為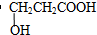 . .(5)寫出A與NaHCO3反應(yīng)的化學(xué)方程式 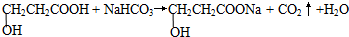 . . |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 原子半徑:Na<Cl | B. | 熱穩(wěn)定性:HCI<HF | ||
| C. | 離子半徑:F-<Mg2+ | D. | 堿性:NaOH<Mg(OH)2 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
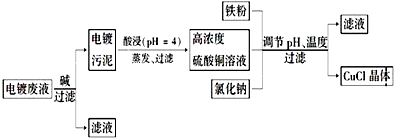
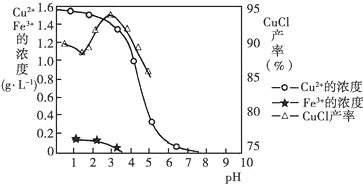
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com