
分析 (1)根據反應熱和轉移電子之間的關系式計算;
(2)I2溶液滴定管為酸式滴定管,因為I2遇到淀粉會變藍色,所以可以用淀粉溶液作指示劑;根據氧化還原反應書寫化學方程式;
(3)根據原電池原理,正極發生的是化合價降低得電子的反應,負極發生氧化反應,根據電極反應判斷pH的變化;
(4)現將NaCl和NaHCO3混合液、CuSO4溶液各400ml.分別盛放在兩電解池中,將插入兩溶液中的惰性電扱串聯,以電池為電源進行電解.
①剛開始時,NaCl和NaHCO3混合液陰極發生還原反應,電極反應式為2H++2e-═H2↑,NaCl和NaHCO3混合液的pH升高的比較緩慢,原因是反應產生的氫氧根離子與碳酸氫根離子反應生成碳酸根和水,導致PH緩慢變化;
②電解硫酸銅溶液后溶液呈酸性,向電解后的溶液中加入堿式碳酸銅能恢復原溶液,堿式碳酸銅和硫酸反應生成硫酸銅、水和二氧化碳,溶液質量增加的量是銅、氫氧根離子,所以實際上電解硫酸銅溶液分兩個階段:第一階段2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4,第二階段:2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑,
將堿式碳酸銅化學式改變為2CuO•H2O•CO2,所以加入0.1molCu2(OH)2CO3 就相當于加入0.2molCuO和0.1mol水,根據氧化銅和水的量計算即可.
解答 解:(1)該反應2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)中,當轉移12mol電子時放出773kJ熱量,當放出熱量154.6kJ熱量轉移2.4mol電子時,
故答案為:2.4mol;
(2)I2溶液滴定管為酸式滴定管,因為I2遇到淀粉會變藍色,所以可以用淀粉溶液作指示劑,滴定終點時溶液的顏色變化為無色變為藍色,反應的離子方程式為H2SO3+I2+H2O=4H++SO42-+2I-;故答案為:酸式;淀粉試液;H2SO3+I2+H2O=4H++SO42-+2I-;
(3)原電池負極發生的是化合價升高失電子的反應,根據方程式可知是二氧化硫失電子,另外,由于H2SO4存在,所以電極反應:SO2+2H2O-2e-═4H++SO42-,該過程T生成氫離子,所以負極pH會減小,
故答案為:SO2+2H2O-2e-═4H++SO42-;減小;
(4)現將NaCl和NaHCO3混合液、CuSO4溶液各400ml.分別盛放在兩電解池中,將插入兩溶液中的惰性電扱串聯,以電池為電源進行電解.
①剛開始時,NaCl和NaHCO3混合液陰極發生還原反應,電極反應式為2H++2e-═H2↑,NaCl和NaHCO3混合液的pH升高的比較緩慢,原因是反應產生的氫氧根離子與碳酸氫根離子反應生成碳酸根和水,導致PH緩慢變化,
故答案為:2H++2e-═H2↑;產生的氫氧根離子與碳酸氫根離子反應生成碳酸根和水,導致PH緩慢變化;
②電解硫酸銅溶液后溶液呈酸性,向電解后的溶液中加入堿式碳酸銅能恢復原溶液,堿式碳酸銅和硫酸反應生成硫酸銅、水和二氧化碳,溶液質量增加的量是銅、氫氧根離子,所以實際上電解硫酸銅溶液分兩個階段:
第一階段2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4,
第二階段:2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑,
將堿式碳酸銅化學式改變為2CuO•H2O•CO2,所以加入0.01molCu2(OH)2CO3 就相當于加入0.02molCuO和0.01mol水,
第一階段:根據銅原子守恒知,電解硫酸銅溶液析出n(Cu)=n(CuO)=0.02mol,轉移電子的物質的量=0.02mol×2=0.04mol;
第二階段:電解生成0.01mol水轉移電子的物質的量=0.01mol×2=0.02mol,
所以電解過程中共轉移的電子數為0.04mol+0.02mol=0.06mol,當有0.04mol電子發生轉移時,此時0.02molH2SO4,而體積為:400ml,所以該溶液中氫離子的濃度為:$\frac{0.02×2}{0.4}$=0.1mol/L,所以溶液的pH=1,故答案為:0.06;1.
點評 本題考查電解原理、氧化還原反應等,清楚發生的電極反應是解題的關鍵,是對學生綜合能力的考查,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 溶解、過濾、蒸發、洗滌 | B. | 溶解、蒸發、洗滌、過濾 | ||
| C. | 溶解、過濾、洗滌、干燥 | D. | 溶解、洗滌、過濾、干燥 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使酚酞變紅的溶液中,這些離子不可大量共存:Cl-,S2-,SO32-,K+ | |
| B. | 向CH3COOH溶液中滴加NaOH的過程中,計算式$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值始終不變 | |
| C. | 苯酚鈉溶液中通入少量CO2,發生反應:2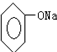 +H2O+CO2→2 +H2O+CO2→2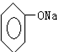 +Na2CO3 +Na2CO3 | |
| D. | 硝酸亞鐵溶液中滴入鹽酸的離子反應方程式為:3Fe2++4H++NO3-═3Fe3++NO+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 反應階段 | Ⅰ | Ⅱ | Ⅲ |
| 鹽酸體積x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 現 象 | 無氣體 | 產生氣體 | 無氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
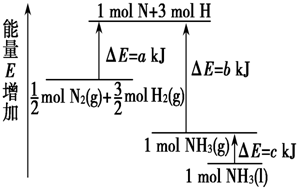
| A. | N2(g)+3H2(g)═2NH3(l)△H=2(a-b-c) kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=2(b-a) kJ•mol-1 | |
| C. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(l)△H=2(b+c-a) kJ•mol-1 | |
| D. | $\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g)△H=2(a+b) kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質量都為4.4g的CH3CHO和CO2含有的分子數均為0.1NA | |
| B. | 1molNa2O2中的離子總數為4NA | |
| C. | 密閉容器中,2molSO2和足量的O2反應轉移的電子數為4NA | |
| D. | 1mol苯分子中所含的碳碳雙鍵數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聞名世界的中國陶瓷、釀酒、造紙技術都充分應用了化學工藝 | |
| B. | 四大發明之一黑火藥是由硫黃、硝石、木炭三種物質按一定比例混合制成 | |
| C. | 工業上電解熔融狀態的Al2O3制備Al | |
| D. | 為預防碘缺乏病,在食鹽中加入碘單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “NO2球”浸泡在冷水中,顏色變淺:2 NO2(g)?N2O4(g)△H<0 | |
| B. | 在反應FeCl3+3KSCN?Fe(SCN)3+3KCl 達平衡后,加入少量KCl固體,平衡逆向移動 | |
| C. | 在兩支盛有雙氧水的試管中,一支加入FeCl3溶液,反應明顯加快,而另一支中加入CuSO4溶液,反應加快但不明顯,說明催化劑具有較強選擇性 | |
| D. | 用MnO2做催化劑,催化雙氧水的分解,是因為MnO2可降低該反應活化能,提高活化分子的百分數 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 屬于同種元素 | B. | 屬于同位素 | C. | 屬于同種核素 | D. | 屬于同種原子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com