
【題目】已知聯氨(N2H4)在水中的電離方程式為N2H4+H2O![]() N2H5++OH-,N2H5++H2O
N2H5++OH-,N2H5++H2O![]() N2H62++OH-。常溫下,將鹽酸逐滴加到聯氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]隨離子濃度變化的關系如圖所示。下列敘述錯誤的是( )
N2H62++OH-。常溫下,將鹽酸逐滴加到聯氨的水溶液中,混合溶液的pOH[pOH=-lgc(OH-)]隨離子濃度變化的關系如圖所示。下列敘述錯誤的是( )
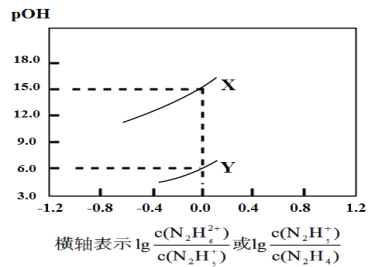
A.曲線X表示pOH與lg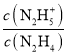 的變化關系
的變化關系
B.反應N2H62++H2O![]() N2H5++H3O+的平衡常數K=10-15
N2H5++H3O+的平衡常數K=10-15
C.聯氨的溶液加水稀釋時聯氨的電離程度逐漸增大
D.N2H5Cl的水溶液中存在等式:c(N2H62+)+c(H3O+)=c(N2H4)+c(OH-)
【答案】AB
【解析】
N2H4+H2ON2H5++OH-,N2H5++H2ON2H62++OH-,當lg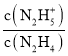 =0時,c(N2H4)=c(N2H5+),Kb1=
=0時,c(N2H4)=c(N2H5+),Kb1=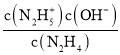 =c(OH-)=10-pOH,當lg
=c(OH-)=10-pOH,當lg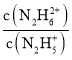 =0時,c(N2H5+)=c(N2H62+),Kb2=
=0時,c(N2H5+)=c(N2H62+),Kb2= =c(OH-)=10-pOH,并且Kb1>Kb2,由圖可知,X點pOH=15.0,Y點pOH=6.0,所以Kb1=10-6.0,Kb2=10-15.0,曲線X表示pOH與lg
=c(OH-)=10-pOH,并且Kb1>Kb2,由圖可知,X點pOH=15.0,Y點pOH=6.0,所以Kb1=10-6.0,Kb2=10-15.0,曲線X表示pOH與lg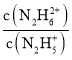 的變化關系,曲線Y表示pOH與lg
的變化關系,曲線Y表示pOH與lg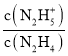 的變化關系,據此分析解答。
的變化關系,據此分析解答。
A.由分析可知,曲線Y表示pOH與lg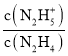 的變化關系,A錯誤;
的變化關系,A錯誤;
B.反應N2H62++H2O![]() N2H5++H3O+的平衡常數為
N2H5++H3O+的平衡常數為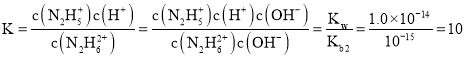 ,B錯誤;
,B錯誤;
C.越稀越電離,聯氨的溶液加水稀釋時,聯氨的電離程度逐漸增大,C正確;
D.N2H5Cl是強酸弱堿鹽,水溶液中存在N2H5+的電離和水解,電荷守恒:2c(N2H62+)+c(H+)+c(N2H5+)=c(Cl-)+c(OH-),物料守恒:
c(N2H62+)+c(N2H4)+c(N2H5+)=c(Cl-),根據物料守恒和電荷守恒,水溶液中存在等式:c(N2H62+)+c(H+)=c(N2H4)+c(OH-),D正確;
故答案為:AB。


科目:高中化學 來源: 題型:
【題目】下列有關實驗原理、裝置、操作或結論的描述正確的是( )
A.圖反應一段時間后試管中液面會下降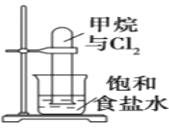
B.圖裝置可用于分離乙醇和乙酸乙酯的混合液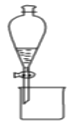
C.圖裝置可用于實驗室制乙炔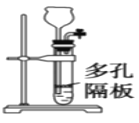
D.圖教材重結晶法提純苯甲酸的實驗中,主要步驟依次為:加熱溶解→趁熱過濾→冷卻結晶→過濾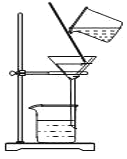
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二甲醚(DME)被譽為“21世紀的清潔燃料”。由合成氣制備二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列問題:
(1)則反應3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,該反應的平衡常數K=________(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,該反應的平衡常數K=________(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3產率的有__________。
A.使用過量的CO B.升高溫度 C.增大壓強
(3)一定溫度下,0.2molCO和0.1molH2O通入2L恒容密閉容器中,發生反應③,5分鐘時達到化學平衡,平衡后測得H2的體積分數為0.1。則5分鐘v(H2O)=_______________,CO的轉化率α(CO)=___________。
(4)將合成氣以![]() =2通入1 L的反應器中,一定條件下發生反應:4H2(g)+2CO(g)
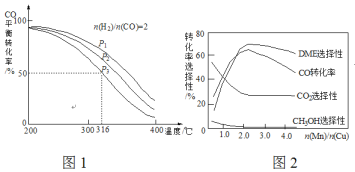
=2通入1 L的反應器中,一定條件下發生反應:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡轉化率隨溫度、壓強變化關系如圖1所示,下列說法正確的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡轉化率隨溫度、壓強變化關系如圖1所示,下列說法正確的是___________。
A.△H <0 B.P1>P2>P3
C.若在P3和316℃時,起始時![]() =3,則平衡時,α(CO)小于50%
=3,則平衡時,α(CO)小于50%
(5)采用一種新型的催化劑(主要成分是Cu-Mn的合金),利用CO和H2制備二甲醚(DME)。觀察圖2回答問題。催化劑中![]() 約為___________時最有利于二甲醚的合成。
約為___________時最有利于二甲醚的合成。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入適量Cl2,溶液中某些離子的物質的量變化如圖所示,下列說法正確的是( )
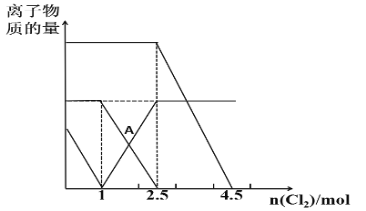
A.三種離子的還原性強弱關系是:Br->Fe2+>I-
B.A點表示Fe2+正好反應了一半
C.原溶液中:n(Fe2+)︰n(I-)︰n(Br-)=2︰1︰3
D.當通入2.5molCl2時,溶液中已發生的離子反應可表示為:6Fe2++4I-+5Cl2=6Fe3++2I2+10Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電滲析法是海水淡化的常用方法,某地海水中主要離子的含量如下表,現利用“電滲析法”進行淡化,技術原理如圖所示(兩端為惰性電極,陽膜只允許陽離子通過,陰膜只允許陰離子通過)。下列說法錯誤的是( )
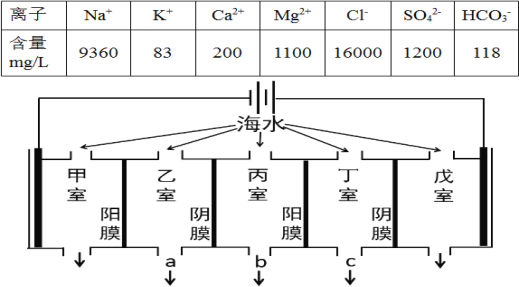
A.淡化過程中易在甲室形成水垢
B.淡化過程中戊室的電極反應式為:2Cl--2e-=Cl2↑
C.淡化過程中乙室和丁室中部分離子的濃度減小,淡水的出口為a、c
D.當甲室收集到標準狀況下11.2L氣體時,通過甲室陽膜的離子的物質的量一定為1mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向10mL0.1mol/LNa2CO3溶液中逐滴加入20mL0.1mol/L的鹽酸,溶液中部分含碳微粒的物質的量隨溶液pH的變化如圖所示。下列說法不正確的是
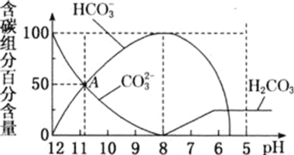
A.HCl溶液滴加一半即10mL時,溶液pH>7
B.0.1mol/LNa2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-)
C.在A點:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.當pH=5時,溶液中c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 時,下列各溶液中有關微粒的物質的量濃度關系正確的是
時,下列各溶液中有關微粒的物質的量濃度關系正確的是![]()
![]()
A.向![]() 溶液中滴加NaOH溶液至恰好呈中性:
溶液中滴加NaOH溶液至恰好呈中性:![]()
B.![]() 溶液呈酸性:
溶液呈酸性:![]()
C.![]() 溶液與
溶液與![]() 溶液混合后的酸性溶液:
溶液混合后的酸性溶液:![]() COO
COO![]()
D.濃度均為![]() 的小蘇打溶液與燒堿溶液等體積混合:
的小蘇打溶液與燒堿溶液等體積混合:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.已知,常溫下H2S、H2CO3的電離常數如表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常溫下,0.1 mol·L-1的硫化鈉溶液和0.1mol·L-1的碳酸鈉溶液,堿性更強的是_______。其原因是_____________________________。
②常溫下,硫化鈉水解的離子方程式為_____________________________。
(2)常溫下,向100mL0.1mol·L-1H2S溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH與NaOH溶液體積的關系曲線如圖所示:

試分析圖中a、b、c、d四個點,水的電離程度最大的是________。
II.減少NO2、SO2、CO等有害氣體對大氣環境的危害,是人類的共同追求。
(3)以甲醇做燃料的電池,如圖所示,其負極反應式為________,該燃料電池在理想狀態下,將有96.5%的化學能轉化成電能,即消耗1mol液體甲醇所能產生的最大電能達702.1kJ,則通常甲醇燃燒的熱化學反應方程式為________。

(4)已知:NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定條件下,將NO2與SO2以體積比1:2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的________。
SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定條件下,將NO2與SO2以體積比1:2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的________。
a.體系壓強保持不變 b.混合氣體顏色保持不變
c.SO3和NO的體積比保持不變 d.每消耗1molSO3的同時生成1molNO2
(5)當上述反應平衡時,測得NO2與SO2體積比為1:6,則平衡常數K=________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com