
 以石墨電極電解200mL CuSO4溶液,電解過程中電子轉移物質的量n(e-)與產生氣體體積V (g)(標準狀況)的關系如圖所示.下列說法中,正確的是( )
以石墨電極電解200mL CuSO4溶液,電解過程中電子轉移物質的量n(e-)與產生氣體體積V (g)(標準狀況)的關系如圖所示.下列說法中,正確的是( )| A. | 電解前CuSO4溶液的物質的量濃度為2mol/L | |
| B. | 電解后所得溶液中c(H+)=2mol/L | |
| C. | 當n(e-)=0.6mol時,V(H2):V(O2)=2:3 | |
| D. | 向電解后的溶液中加入16gCuO,則溶液可恢復為電解前的濃度 |
分析 石墨電極電解200mL CuSO4溶液,先發生2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4,后發生2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑,結合圖象可知,生成2.24L氣體時轉移0.4mol電子發生2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4,以此來計算解答.
解答 解:A.由生成2.24L氣體時轉移0.4mol電子發生2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4,則n(CuSO4)=$\frac{2.24L}{22.4L/mol}$×2=0.2mol,c(CuSO4)=$\frac{0.2mol}{0.2L}$=1mol/L,故A錯誤;
B.生成2.24L氣體時轉移0.4mol電子,當轉移0.4mol電子時,生成n(H2SO4)=0.2mol,c(H+)=$\frac{0.2mol×2}{0.2L}$=2mol/L,隨電解的進行,水繼續電解,溶劑減小,則電解后所得溶液中c(H+)>2mol/L,故B錯誤;
C.當n(e-)=0.6mol時,發生2CuSO4+2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑~4e-,n(H2)=$\frac{0.2mol×2}{4}$=0.1mol,n(O2)=0.1mol+0.05mol=0.15mol,所以V(H2):V(O2)=0.1mol:0.15mol=2:3,故C正確;
D.因電解后從溶液中析出Cu、氧氣、水,則加入16gCuO不會恢復為電解前的濃度,故D錯誤;
故選C.
點評 本題考查電解原理及計算,明確發生的電解反應及圖象中體積與轉移電子的關系即可解答,注意從溶液中析出Cu、氧氣、水結合電解反應中轉移的電子數來計算,題目難度中等.


 海淀黃岡名師導航系列答案
海淀黃岡名師導航系列答案 普通高中同步練習冊系列答案
普通高中同步練習冊系列答案 優翼小幫手同步口算系列答案
優翼小幫手同步口算系列答案科目:高中化學 來源: 題型:解答題
 .
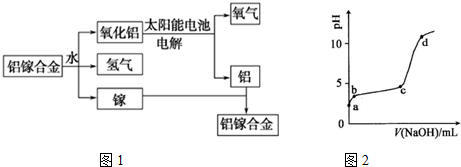
.
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 溶質的電離方程式為NaHSO3═Na++H++SO32- | |
| B. | c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) | |
| D. | 加入少量NaOH固體,c(HSO3-)與c(Na+)均增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
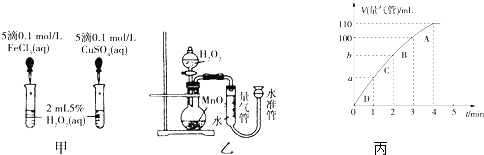
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
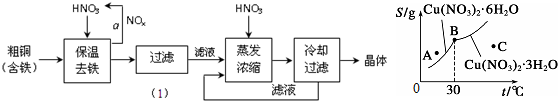
| A. | C點溶液為Cu(NO3)2的不飽和溶液 | |
| B. | 30℃時結晶可析出兩種晶體 | |
| C. | 按上述流程最終得到的晶體是Cu(NO3)2•3H2O | |
| D. | 將A點溶液升溫至30℃時,可以析出Cu(NO3)2•3H2O晶體. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 離子 | Fe 2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 為了合理利用化學能,確保安全生產,化工設計需要充分考慮化學反應的焓變,并采取相應措施.化學反應的焓變通常用實驗進行測定,也可進行理論推算.
為了合理利用化學能,確保安全生產,化工設計需要充分考慮化學反應的焓變,并采取相應措施.化學反應的焓變通常用實驗進行測定,也可進行理論推算.| 化學鍵 | H-H | N-H | N≡N |
| 鍵能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液質量與白色固體的質量均保持不變 | |
| B. | 溶液濃度和pH值均保持不變,溶液下部是1.73g氫氧化鋇固體 | |
| C. | 溶液中鋇離子與氫氧根離子的數目均保持不變,${\;}^{1{8}^{\;}}$O存在于溶液和固體中,固體質量大于1.73克 | |
| D. | 溶液中鋇離子與氫氧根離子的物質的量的濃度保持不變,${\;}^{1{8}^{\;}}$O存在于溶液和固體中,固體質量大于1.73克 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com