
【題目】如圖是可逆反應X2+3Y2 ![]() 2Z2在反應過程中的反應速率(v)與時間(t)的關系曲線,下列敘述不正確的是
2Z2在反應過程中的反應速率(v)與時間(t)的關系曲線,下列敘述不正確的是
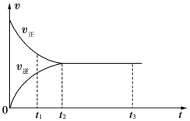
A. t1時,只有正方向反應
B. t2~t3,反應仍在進行
C. t2時,反應到達限度
D. t2~t3,各物質的濃度不再發生變化
 手拉手全優練考卷系列答案
手拉手全優練考卷系列答案科目:高中化學 來源: 題型:
【題目】新華網報道,我國固體氧化物燃料電池技術研發取得新突破。科學家利用該技術實現了H2S廢氣資源回收能量,并得到單質硫的原理如圖所示。下列說法正確的是

A. 電極b為電池負極
B. 電路中每流過4mol電子,正極消耗44.8LH2S
C. 電極b上的電極反應為:O2+4e-+4H+=2H2O
D. 電極a上的電極反應為:2H2S+2O2--4e-=S2+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)科研人員設想用如圖所示裝置生產硫酸。
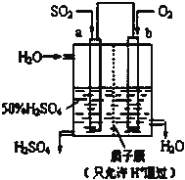
①上述生產硫酸的總反應方程式為_____,b是_____極(填“正”或“負”),a電極反應式為_______,生產過程中H+向_____(填a或b)電極區域運動。
②該小組同學反思原電池的原理,其中觀點正確的是_____(填字母)。
A.原電池反應的過程中可能沒有電子發生轉移
B.原申池裝置需要2個活潑性不同的金屬電極
C.電極一定不能參加反應
D.氧化反應和還原反應可以拆開在兩極發生
(2)若需將反應:Cu+2Fe3+=Cu2++2Fe2+設計成原電池裝置,則負極材料為_____,電解質溶液為_____。
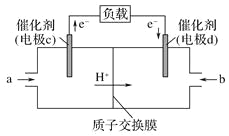
(3)CO與H2反應還可制備CH3OH,CH3OH可作為燃料使用,用CH3OH和O2組合形成的質子交換膜(只允許H+通過)燃料電池的結構示意圖如圖:電池總反應為2CH3OH+3O2=2CO2+4H2O,c電極為_____極(填“正”或“負”),c電極反應方程式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,分別取濃度不同、體積均為20.00mL的3種HCl溶液,分別滴入濃度為1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,測得3個反應體系的pH隨V(NaOH)的變化的曲線如圖,在V(NaOH)=20.00mL前后出現突躍。下列說法不正確的是
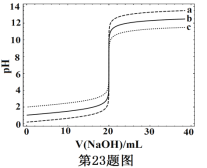
A. 3種HCl溶液的c(HCl):最大的是最小的100倍
B. 曲線a、b、c對應的c(NaOH):a>b>c
C. 當V(NaOH)=20.00mL時,3個體系中均滿足:c(Na+)=c(Cl-)
D. 當V(NaOH)相同時,pH突躍最大的體系中的c(H+)最大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學用下列裝置完成了濃硫酸和SO2性質實驗(夾持裝置已省略)。請回答:
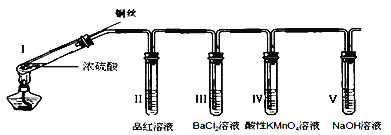
(1)下列說法正確的是__________。
A.反應后,將試管Ⅰ中的白色固體加入水中,溶液呈藍色
B.取下試管Ⅲ并不斷振蕩,試管中出現渾濁,是因為生成了BaSO4
C.試管Ⅳ中KMnO4溶液褪色,說明SO2具有氧化性
D.試管V中的NaOH溶液可用Na2CO3溶液代替
(2)取下試管Ⅱ,在該試管口套上氣球,將無色溶液加熱恢復至紅色,冷卻后,發現溶液顏色再次變淺。解釋“無色→紅色→顏色變淺”變化的原因______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】納米級Cu2O由于具有優良的催化性能而受到關注,下述為制取Cu2O的兩種方法:
方法a:用炭粉在高溫條件下還原CuO
方法b:電解法,反應為2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H1=akJ/mol
O2(g)=Cu2O(s)△H1=akJ/mol
②C(s)+![]() O2(g)=CO(g) △H2=bkJ/mol
O2(g)=CO(g) △H2=bkJ/mol
③Cu(s)+![]() O2(g)=CuO(s)△H3=ckJ/mol
O2(g)=CuO(s)△H3=ckJ/mol
則方法a中反應的熱化學方程式是:_________________。
(2)方法b是用肼燃料電池為電源,通過離子交換膜電解法控制電解液中OH-的濃度而制備納米Cu2O裝置如圖所示:
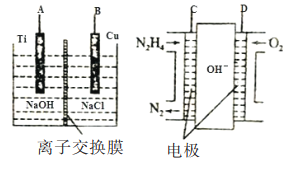
①如圖裝置中D電極應連______電極。(填“A”或“B”)
②該離子交換膜為______離子交換膜(填“陰”或“陽”),該電解池的B極反應式為:______。
③C極反應式為:__________。
(3)在相同體積的恒容密閉容器中,用以上方法制得的兩種Cu2O分別進行催化分解水的實驗:
2H2O![]() 2H2(g)+O2(g) △H>0,水蒸氣的濃度隨時間t變化如表所示:
2H2(g)+O2(g) △H>0,水蒸氣的濃度隨時間t變化如表所示:
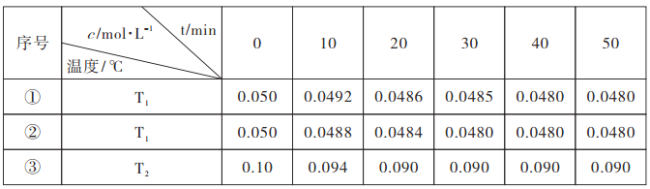
根據上述數據分析:
①催化劑的效率:實驗①_______實驗②(填“>”或“<”);
②通過實驗①、③分析,T1______T2(填“>”或“<”);
③實驗①、②、③的化學平衡常數K1、K2、K3的大小關系為:_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數變化如圖所示。已知 W 的一種核素的質量數為18,中子數為10;X 和 Ne 的核外電子數相差1; 在Z所在的周期中,Z 元素的原子得電子能力最強;四種元素的最外層電子數之和為18。 請回答下列問題:
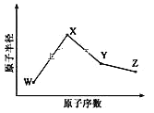
(1)X 元素位于元素周期表中位置為____________。
(2)Z 的同族簡單氫化物中,穩定性最好的是________(寫化學式),原因__________________。
(3)W、X、Z 三種元素形成的化合物中化學鍵類型為___________;X2W2的電子式為________。
(4)Y 與 Z 形成的化合物YZ4在常溫下是一種液態,它和足量水反應,生成一種弱酸和一種強酸,該反應的化學方程式為__________________________。
(5)Z 的氧化物很多,其中一種黃綠色氣體M,其氧含量為 47.41%,可用于水處理, M 在液態和濃縮氣態時具有爆炸性。 M 可與 NaOH 溶液反應生成兩種穩定的鹽,它們的物質的量之比為 1︰5,該反應的化學方程式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國中科院上海生化所于1982年5月合成了一種藥物——腦啡肽,下面是它的結構簡式。有關敘述正確的是( )

①腦啡肽為四肽化合物 ②組成腦啡肽的氨基酸共有4種R基
③一個腦啡肽完全水解所得氨基酸中共有5個游離的氨基
④反應物合成一個腦啡肽后,有機物中O原子減少了5個
A. ① B. ①④ C. ②③ D. ②③④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com