

 NH4++ NH2-,某溫度時,其離子積K=2×l0-30。該溫度下:①將少量NH4Cl固體加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②將少量金屬鈉投入液氨中,完全反應后所得溶液中各微粒的濃度大小關系為:_______
NH4++ NH2-,某溫度時,其離子積K=2×l0-30。該溫度下:①將少量NH4Cl固體加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②將少量金屬鈉投入液氨中,完全反應后所得溶液中各微粒的濃度大小關系為:_______| A.c(NH4+)/c(NH3?H2O) | B.c(NH3?H2O)/c(OH-) |
| C.c(H+)/c(NH4+) | D.c(OH-)/c(H+) |
 2NH3(g)+2(E3-E1)kJ/mol; 催化劑
2NH3(g)+2(E3-E1)kJ/mol; 催化劑 2NH3(g)+2(E3-E1)kJ/mol;改變某一條件,降低了反應的活化能,使很多原來不能反應的分子變為活化分子,提高了活化分子的百分比率,反應速率加快。這是催化劑的作用。
2NH3(g)+2(E3-E1)kJ/mol;改變某一條件,降低了反應的活化能,使很多原來不能反應的分子變為活化分子,提高了活化分子的百分比率,反應速率加快。這是催化劑的作用。 2NH3(g)可知達平衡時各種物質的物質的量為n(N2)=amol;n(H2)="amol" n(NH3)=2amol.若在此時再向該容器中投入a mol H2、amol N2和2amol NH3。相當于將容器的容積壓縮至原來的一半。由于壓強增大的影響大于濃度增大的影響,所以增大壓強。化學平衡向氣體體積減小的反應方向移動。由于該反應的正反應是氣體體積減小的反應,所以在此時再向該容器中投入a mol H2、amol N2和2amol NH3,化學平衡向正反應方向移動。
2NH3(g)可知達平衡時各種物質的物質的量為n(N2)=amol;n(H2)="amol" n(NH3)=2amol.若在此時再向該容器中投入a mol H2、amol N2和2amol NH3。相當于將容器的容積壓縮至原來的一半。由于壓強增大的影響大于濃度增大的影響,所以增大壓強。化學平衡向氣體體積減小的反應方向移動。由于該反應的正反應是氣體體積減小的反應,所以在此時再向該容器中投入a mol H2、amol N2和2amol NH3,化學平衡向正反應方向移動。 NH4++ NH2-。若將少量金屬鈉投入液氨中,發生反應2Na+ 2NH4+=2NaNH2+H2↑.由于消耗了NH4+,破壞了電離平衡,促使NH3向電離的方向移動。最終達到平衡。由于NH3的電離程度是很微弱的。所以完全反應后所得溶液中各微粒的濃度大小關系為:c(NH3)>c(NH2-)>c(Na+)>c(NH4+)。
NH4++ NH2-。若將少量金屬鈉投入液氨中,發生反應2Na+ 2NH4+=2NaNH2+H2↑.由于消耗了NH4+,破壞了電離平衡,促使NH3向電離的方向移動。最終達到平衡。由于NH3的電離程度是很微弱的。所以完全反應后所得溶液中各微粒的濃度大小關系為:c(NH3)>c(NH2-)>c(Na+)>c(NH4+)。 NH4++OH-。用水稀釋0.1mol/L稀氨水時。若平衡不移動,c(NH3?H2O)、c(NH4+)、c(OH-)都減小。但加水稀釋時平衡向電離的方向移動,c(NH3?H2O)進一步減小,c(NH4+)、c(OH-)的濃度在減小的基礎上又略有增加。但由于在溶液中存在水的電離平衡H2O
NH4++OH-。用水稀釋0.1mol/L稀氨水時。若平衡不移動,c(NH3?H2O)、c(NH4+)、c(OH-)都減小。但加水稀釋時平衡向電離的方向移動,c(NH3?H2O)進一步減小,c(NH4+)、c(OH-)的濃度在減小的基礎上又略有增加。但由于在溶液中存在水的電離平衡H2O H+ +OH-。c(H+)·c(OH-)=Kw,c(OH-)減小,所以c(H+)增大。所以c(NH4+)/c(NH3?H2O)增大;A錯誤。(NH3?H2O)/c(OH-)減小;B正確。C.c(H+)/c(NH4+)增大。錯誤。D.c(OH-)/c(H+)減小,正確。故選項為B、D。
H+ +OH-。c(H+)·c(OH-)=Kw,c(OH-)減小,所以c(H+)增大。所以c(NH4+)/c(NH3?H2O)增大;A錯誤。(NH3?H2O)/c(OH-)減小;B正確。C.c(H+)/c(NH4+)增大。錯誤。D.c(OH-)/c(H+)減小,正確。故選項為B、D。

 金鑰匙試卷系列答案
金鑰匙試卷系列答案科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 H2O(l) ΔH="-57.3" kJ·mol-1,回答下列問題。
H2O(l) ΔH="-57.3" kJ·mol-1,回答下列問題。查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
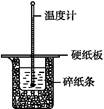
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.是吸熱反應 |
| B.是放熱反應 |
| C.吸收183 kJ熱量 |
| D.放出183 kJ熱量 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 HBr+H的能量對反應歷程的示意圖。下列敘述正確的是( )
HBr+H的能量對反應歷程的示意圖。下列敘述正確的是( )
| A.正反應為放熱反應 |
| B.加入催化劑,該化學反應的反應熱變大 |
| C.反應物總能量低于生成物總能量 |
| D.升高溫度可增大正反應速率,降低逆反應速率 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.2H2(g)+O2(g)=2H2O(l) ΔH1;2H2(g)+O2(g)=2H2O(g) ΔH2 |
| B.S(g)+O2(g)=2SO2(g) ΔH1;S(s)+O2(g)=2SO2(g) ΔH2 |
C.C(s)+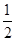 O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2 O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2 |
D.H2(g)+Cl2(g)=2HCl(g) ΔH1;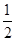 H2(g)+ H2(g)+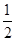 Cl2(g)=HCl(g) ΔH2 Cl2(g)=HCl(g) ΔH2 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
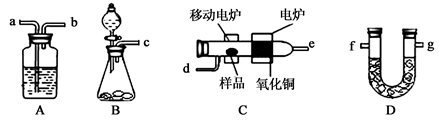
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
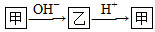 。請回答下列問題:
。請回答下列問題:
 H2NCOONH4(l)(氨基甲酸銨) ΔH1
H2NCOONH4(l)(氨基甲酸銨) ΔH1 H2O(l)+H2NCONH2(l)(尿素) ΔH2
H2O(l)+H2NCONH2(l)(尿素) ΔH2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com