
【題目】用KMnO4氧化一定體積密度為1.19g/cm3 , 溶質質量分數為36.5%的 鹽酸.反應方程式如下:2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用雙線橋法分析該反應(只需標出電子得失的方向和數目)
(2)15.8g KMnO4參加反應能消耗多少摩爾HCl?
(3)產生的Cl2在標準狀況下的體積為多少升?
【答案】
(1)解:反應中高錳酸鉀為氧化劑,濃鹽酸為還原劑,Mn元素的化合價+7→+2,和Cl元素的化合價﹣1→0,反應中氧化劑和還原劑得失電子數目相等,則轉移電子數為10e﹣,所以雙線橋法可表示為: 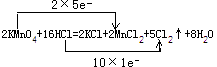 ;
;
故答案為: 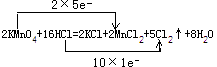
(2)解:設參加反應的HCl的物質的量為n,則:
2KMnO4 | + | 16HCl | = | 2KCl | + | 2MnCl2 | + | 5Cl2↑ | + | 8H2O |
2×158 | 16 | |||||||||
15.8g | n |
n= ![]() =0.8mol
=0.8mol
答:15.8g KMnO4參加反應能消耗0.8molHCl
(3)解:設生成氯氣的物質的量為a,則:
2KMnO4 | + | 16HCl | = | 2KCl | + | 2MnCl2 | + | 5Cl2↑ | + | 8H2O |
2×158 | 5 | |||||||||
15.8g | a |
所以a= ![]() =0.25mol,
=0.25mol,
故生成標況下氯氣的體積為0.25mol×22.4L/mol=5.6L,
答:標況下生成氯氣的體積為5.6L
【解析】(1)反應中高錳酸鉀為氧化劑,濃鹽酸為還原劑,根據Mn元素的化合價+7→+2,和Cl元素的化合價﹣1→0,標出電子的轉移方向和數目;(2)根據方程式計算需要HCl的物質的量;(3)據方程式計算生成氯氣的物質的量,再根據V=22.4n計算生成氯氣的體積.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】從晶體與非晶體的角度分析,普通玻璃和水晶的根本區別是( )
A.外形不一樣
B.普通玻璃的基本構成粒子無序排列,水晶的基本構成粒子呈周期性有序排列
C.水晶有固定的熔點,普通玻璃無固定的熔點
D.水晶可用于能量轉換,普通玻璃不能用于能量轉換
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.凡是放熱反應的發生均無需加熱
B.凡是需要加熱后才能發生的反應是吸熱反應
C.伴有能量變化的物質變化都是化學變化
D.物質發生化學反應都伴隨著能量變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N4分子結構為正四面體(如圖所示)。已知:斷裂N4(g)中1 molN-N鍵吸收193kJ能量,形成N2(g)中1 mol N![]() N放出941 kJ能量。下列說法正確的是
N放出941 kJ能量。下列說法正確的是
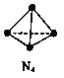
A. N4(g)比N2(g)更穩定
B. N4(g)=2N2(g) △H=+724kJmol-1
C. 形成1 mol N4(g)中的化學鍵放出193 kJ的能量
D. lmolN2(g)完全轉化為N4(g),體系的能量增加362kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應 SiO2(s)+C(s)+N2(g)![]() Si3N4(s)+CO(g)(未配平)△H <0,下列敘述正確的是
Si3N4(s)+CO(g)(未配平)△H <0,下列敘述正確的是
A. 該反應的氧化劑為N2,還原產物為CO
B. 增加焦炭的用量,生成氮化硅的反應速率增大
C. 反應中每生成0.1 mol Si3N4轉移的電子為1.2 mol
D. 反應的平衡常數可表示為K=c(CO)/c(N2),升高溫度K減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于苯的硝化反應,下列說法不正確的是( )
A.濃硫酸起了催化劑、吸水劑的作用
B.加熱50-60℃通常通過水浴來實現
C.由于苯和硝酸都易揮發,所以通常需要加冷凝裝置
D.純凈的硝基苯為深黃色比水重的液體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知31g白磷(P4)變為31g紅磷(P)時釋放能量。上述變化屬于__變化(填“物理”或“化學”);穩定性白磷__紅磷(填“>”或“<”);
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com