
【題目】下圖為有關分子在催化劑作用下發生轉化的示意圖,下列敘述正確的是( )。
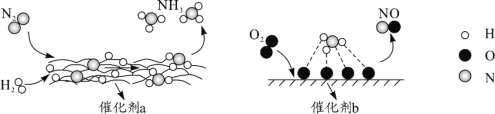
A.N2→NH3,NH3→NO均屬于氮的固定
B.催化劑a作用下氮原子發生了氧化反應
C.催化劑a、b表面均發生了極性共價鍵的斷裂
D.使用催化劑a、b均可以提高單位時間內生成物的產量
 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:
【題目】合成一種用于合成 γ 分泌調節劑的藥物中間體,其合成的關鍵一步如圖。下列有關化合物甲、乙的說法正確的是

A.甲→乙的反應為加成反應
B.甲分子中至少有 8 個碳原子在同一平面上
C.甲、乙均不能使溴水褪色
D.乙與足量 H2 完全加成的產物分子中含有 4 個手性碳原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素![]() 在元素周期表中的相對位置如圖所示,其中w原子的最外層電子數是最內層電子數的3倍.下列判斷不正確的是
在元素周期表中的相對位置如圖所示,其中w原子的最外層電子數是最內層電子數的3倍.下列判斷不正確的是![]()

A.x與同主族且相鄰元素的氣態氫化物的沸點,前者高于后者
B.含Y元素的鹽溶液有的顯酸性,有的顯堿性
C.x的氣態氫化物與w的最高價氧化物的水化物反應只能生成一種鹽
D.x與H、O元素形成的化合物可以組成一種鹽,其中![]() 元素原子個數之比為2:4:3
元素原子個數之比為2:4:3
查看答案和解析>>
科目:高中化學 來源: 題型:
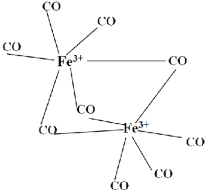
【題目】羰基鐵[Fe(CO)5]廣泛用于催化劑,汽油抗爆劑,電子工業高頻線圈制造。請回答下列問題:
(1)羰基鐵[Fe(CO)5]中,碳、氧電負性大小比較____(用元素符號表示)。寫出基態O的軌道表示式____;
(2)CO分子中C原子上有一對孤對電子,C、O原子都符合8電子穩定結構,CO分子中C原子的雜化類型為____雜化。
(3)1molFe(CO)5分子中含σ鍵數目為____;CO配體中的配位原子是____。
(4)科學家通過X射線探明,FeO、MgO、CaO的晶體結構與NaCl晶體結構相似,比較晶體熔點的高低MgO____CaO(填“高于”或“低于”)
(5)羰基鐵[Fe(CO)5]中鐵為0價。如圖中的羰基鐵為+3價,此羰基鐵的晶體類型為____;此羰基鐵中每個鐵的配位數是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為元素周期表中部分元素某種性質![]() 值
值![]() 隨原子序數變化的關系。
隨原子序數變化的關系。

(1)短周期中原子核外p能級上電子總數與s能級上電子總數相等的元素是______![]() 填元素符號
填元素符號![]() 。
。
(2)同周期,隨著原子序數的增大,X值變化趨勢為______再結合同主族不同元素的X值變化的特點,體現了元素性質的______變化規律。
(3)X值較小的元素集中在元素周期表的______![]() 填序號
填序號![]()
A.左下角![]() 右上角
右上角![]() 分界線附近
分界線附近
(4)下列關于元素此性質的說法中正確的是______![]() 填序號
填序號![]() 。
。
A.X值可反映元素最高正化合價的變化規律
B.X值可反映原子在分子中吸引電子的能力
C.X值的大小可用來衡量元素金屬性和非金屬性的強弱
(5)SiHCl3與水發生的化學反應可認為是廣義的水解反應,根據圖中數據,該反應的化學方程式為______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向50mL含有0.1molCl2的氯水中滴加2mol·L1的NaOH溶液,得到溶液pH隨加入NaOH溶液體積的變化如圖所示。下列說法正確的是
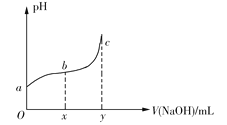
A.若a點pH=4,且c(Cl)=mc(HClO),則HClO的電離平衡常數為![]()
B.若x=100,b點對應溶液中,c(OH)>c(H+),可用pH試紙測定其pH
C.若y=200,c點對應溶液中,c(OH)c(H+)=2c(Cl)+c(HClO)
D.b→c段,隨NaOH溶液的滴入,![]() 逐漸增大
逐漸增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家成功合成了世界上首個五氮陰離子鹽(H3O)3(NH4)4(N5)6Cl(用R代表),請根據其組成的元素和結構回答下列問題:
(1)氮原子價層電子的軌道表達式為_____________________。
(2)第一電離能N______O(填“>”、“<”或“=”),其原因是_____________。
(3)經X射線衍射測得化合物R的晶體結構,其局部結構如下圖所示。
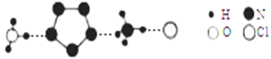
①R中兩種陽離子的相同之處為_________,不同之處為__________。(填標號)
a.中心原子的雜化軌道類型 b.中心原子的價層電子對數
c.立體結構 d.共價鍵類型
②R中陰離子N5-中的σ鍵總數為________個。大π鍵可用符號πmn表示,其中m為形成大π鍵的原子數,n為形成大π鍵的電子數,則N5-中的大π鍵應表示為__________。
③圖中虛線代表氫鍵,其表示式為(NH4+)NH…Cl、___________、____________。
(4)提取煉銅的陽極泥中金、銀、鉑時,用到王水(HNO3和HCl的物質的量之比為1∶3的混酸),過程如下:
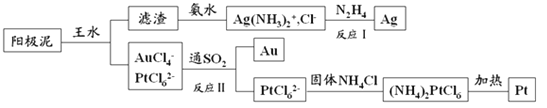
①濾渣的成分是_____________,(NH4)2PtCl6中配體是_______________________。
②金和濃硝酸反應的化學方程式為:Au+6HNO3(濃)=Au(NO3)3+3NO2↑+3H2O,該反應的平衡常數很小,幾乎不反應,但金卻可以溶于王水,原因是____________________,試寫出該反應的化學方程式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過海水晾曬可得粗鹽,粗鹽除NaCl外,還含有MgCl2、CaCl2、Na2SO4以及泥沙等雜質,需要提純后才能綜合利用,粗鹽精制的實驗流程如下。
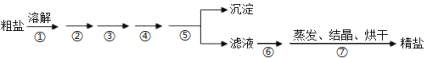
(1)下列說法不正確的是(__________)
A.在第①步中使用玻璃棒攪拌可加速粗鹽溶解
B.第⑤步操作是過濾
C.在第②③④⑥步通過加入化學試劑除雜,加入試劑順序為:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀鹽酸
D.除去MgCl2的離子方程式為:Mg2++2OH=Mg(OH)2↓
(2)判斷SO42-已除盡的方法是___。
(3)電解精制NaCl溶液可得到NaOH、Cl2和H2,它們是重要的化工原料。有關反應關系如圖所示:(部分反應條件和物質省略)
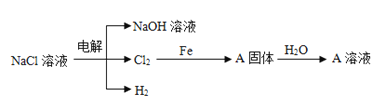
①Cl2與NaOH溶液反應可以制取“84”消毒液,發生反應的離子方程式為:__。
②寫出Cl2和鐵反應化學方程式,并用雙線橋標出電子轉移的方向和數目:__,標準狀況下,22.4LCl2與足量的Fe反應,則反應過程中轉移__個電子。
(4)向足量A溶液中加入少量的鈉完全反應前后A溶液質量變化__(填“增大”或“減小”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】BF3與一定量的水形成(H2O)2·BF3,一定條件下(H2O)2·BF3可發生如圖轉化,下列說法中正確的是
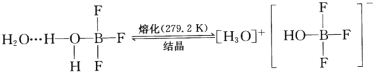
A.(H2O)2·BF3熔化后得到的物質屬于離子晶體
B.(H2O)2·BF3分子間存在著配位鍵和氫鍵
C.BF3是僅含極性共價鍵的非極性分子
D.基態B原子核外電子的空間運動狀態有5種
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com