
【題目】研究氮氧化物的反應機理,對于消除環境污染有重要意義。
(1)升高溫度絕大多數的化學反應速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率卻隨溫度的升高而減小,某化學小組為研究特殊現象的實質原因,查閱資料知:2NO(g)+O2(g)
2NO2(g)的速率卻隨溫度的升高而減小,某化學小組為研究特殊現象的實質原因,查閱資料知:2NO(g)+O2(g)![]() 2NO2(g)的反應歷程分兩步:
2NO2(g)的反應歷程分兩步:
i:2NO(g)![]() N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
ii:N2O2(g)+O2(g)![]() 2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
請回答下列問題:
①一定溫度下,反應2NO(g)+O2(g)![]() 2NO2(g)達到衡狀態,請寫出用k1正、k1逆、k2正、k2逆表示的平衡常數表達式K=________
2NO2(g)達到衡狀態,請寫出用k1正、k1逆、k2正、k2逆表示的平衡常數表達式K=________
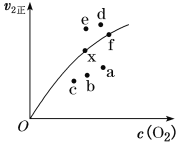
②由實驗數據得到v2正~c(O2)的關系可用如圖表示。當x點升高到某一溫度時,反應重新達到平衡,則變為相應的點為___________(填字母)。
(2)100℃時,若將0.100 mol N2O4氣體放入1 L密閉容器中,發生反應N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)隨時間的變化如表所示。回答下列問題:
2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)隨時間的變化如表所示。回答下列問題:

①在0~40 s時段,化學反應速率v(NO2)為______ mol·L-1·s-1
②下列能說明該反應達到平衡狀態的是________(填選項字母)。
A.2v(N2O4)=v(NO2) B.體系的顏色不再改變
C.混合氣體的密度不再改變 D.混合氣體的壓強不再改變
③該反應達到平衡后,若只改變一個條件,達到新平衡時,下列能使NO2的體積分數增大的是_________(填選項字母)。
A.充入一定量的NO2 B.增大容器的容積
C.分離出一定量的NO2 D.充入一定量的N2
④100℃時,若將9.2 g NO2和N2O4氣體放入1 L密閉容器中,發生反應N2O4(g)![]() 2NO2(g)。某時刻測得容器內氣體的平均相對分子質量為50,則此時v正(N2O4)_______v逆(N2O4)(填“>”“=”或“<”)。
2NO2(g)。某時刻測得容器內氣體的平均相對分子質量為50,則此時v正(N2O4)_______v逆(N2O4)(填“>”“=”或“<”)。
⑤上述反應中,正反應速率v正=k正·p(N2O4),逆反應速率v逆=k逆·p2(NO2),其中k正、k逆為速率常數,若將一定量N2O4投入真空容器中恒溫恒壓分解(溫度298 K、壓強100 kPa),已知該條件下k正=4.8×104 s-1,當
【答案】![]() a 0.0025 BD BC < 3.9×106
a 0.0025 BD BC < 3.9×106
【解析】
(1)①由反應達平衡狀態,所以![]() ,所以
,所以![]() ,
, ![]() ,據此分析;
,據此分析;
②![]() 的速率隨溫度的升高而減小,因為決定該反應速率的是反應②,故升高到溫度時v2正減小,且平衡逆向移動,氧氣的濃度增大;
的速率隨溫度的升高而減小,因為決定該反應速率的是反應②,故升高到溫度時v2正減小,且平衡逆向移動,氧氣的濃度增大;
(2)①![]() ,由反應速率之比等于化學計量數之比,則
,由反應速率之比等于化學計量數之比,則![]() ;
;
②平衡狀態的判定;
③利用等效平衡思想解決;
④題干中給出的數據算出平均分子量=氣體總質量氣體總的物質的量=![]() =57.5g/mol,某時刻測得容器內氣體的平均相對分子質量為50,說明反應需向體積縮小的方向進行;
=57.5g/mol,某時刻測得容器內氣體的平均相對分子質量為50,說明反應需向體積縮小的方向進行;
⑤列三段式解出![]() 的分壓,計算即可。
的分壓,計算即可。
(1)①![]() ;②
;②![]() ;目標反應
;目標反應![]() ,由反應達平衡狀態,所以
,由反應達平衡狀態,所以![]() ,所以
,所以![]() ,
, ![]() ,則
,則![]() ,故答案為:
,故答案為:![]() ;
;
②![]() 的速率隨溫度的升高而減小,因為決定該反應速率的是反應②,故升高到溫度時v2正減小,且平衡逆向移動,氧氣的濃度增大,所以反應重新達到平衡,則變為相應的點為a,故答案為:a;
的速率隨溫度的升高而減小,因為決定該反應速率的是反應②,故升高到溫度時v2正減小,且平衡逆向移動,氧氣的濃度增大,所以反應重新達到平衡,則變為相應的點為a,故答案為:a;
(2)①由表可知,040s時間內![]() 的濃度由0.10mol/L減小為0.050mol/L,則其反應速率為
的濃度由0.10mol/L減小為0.050mol/L,則其反應速率為![]() ,由反應速率之比等于化學計量數之比,則
,由反應速率之比等于化學計量數之比,則![]() 的反應速率為
的反應速率為![]() ,故答案為:0.0025;
,故答案為:0.0025;
②A.未體現正逆反應速率的關系,A錯誤;
B.體系的顏色不再改變,說明二氧化氮的濃度不變,B正確;
C.無論是否反應,體系的混合氣體的總質量不變,體積不變,故密度不變,C錯誤;
D.該反應正反應為體積增大的反應,混合氣體的壓強不再改變,說明氣體的物質的量不變,達到平衡狀態,D正確;
故答案為:BD;
③A. 充入一定量的![]() ,相當于加壓,達新平衡時,則
,相當于加壓,達新平衡時,則![]() 的體積分數減小,故A錯誤;
的體積分數減小,故A錯誤;
B. 增大容器的容積,減壓,平衡向體積增大的方向移動,即正向移動,![]() 的體積分數增大,故B正確;
的體積分數增大,故B正確;
C. 分離出一定量的![]() ,相當于減壓,使
,相當于減壓,使![]() 的體積分數增大,故C正確;
的體積分數增大,故C正確;
D. 充入一定量的![]() ,總壓增大,氣體分壓不變,不會引起化學平衡的移動,二氧化氮濃度不變,故D錯誤;
,總壓增大,氣體分壓不變,不會引起化學平衡的移動,二氧化氮濃度不變,故D錯誤;
故答案為:BC;
④100℃時,將0.100mol![]() 氣體放入1L密閉容器中,平衡時,
氣體放入1L密閉容器中,平衡時,![]() ,
,![]() ,平均分子量=氣體總質量氣體總的物質的量=
,平均分子量=氣體總質量氣體總的物質的量=![]() =57.5g/mol,將9.2g
=57.5g/mol,將9.2g![]() 和
和![]() 氣體放入1L密閉容器中,某時刻測得容器內氣體的平均相對分子質量為50,說明反應需向體積縮小的方向進行,即
氣體放入1L密閉容器中,某時刻測得容器內氣體的平均相對分子質量為50,說明反應需向體積縮小的方向進行,即![]() ,故答案為:<;
,故答案為:<;
⑤當N2O4分解10%時,設投入的N2O4為1mol,轉化的N2O4為0.1mol,則: ,故此時
,故此時![]() ,則
,則![]() ,故答案為:3.9×106。
,故答案為:3.9×106。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】對于放熱反應Zn+H2SO4=ZnSO4+H2↑,下列敘述正確的是
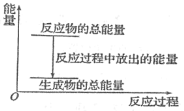
A.反應過程中的能量關系可用上圖表示
B.1 mol Zn的能量大于1 mol H2的能量
C.若將其設計為原電池,則其能量轉化形式為電能轉化為化學能
D.若將其設計為原電池,當有32.5 g Zn溶解時,正極放出的氣體一定為11.2 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物YX2、ZX2中,X、Y、Z的核電荷數小于18;X原子最外能層的p能級中有一個軌道充填了2個電子,Y原子的最外層中p能級的電子數等于前一能層電子總數,且X和Y具有相同的電子層;Z與X在周期表中位于同一主族。回答下列問題:
(1)X的價電子排布式為____________,Y的電子排布圖為___________;
(2)ZX2的分子式是________________,VSEPR模型名稱為________________。YX2的電子式是______________,中心原子發生了________雜化。
(3)Y與Z形成的化合物的分子式是_______________。Y的氫化物中分子構型為正四面體的是_________(填名稱),鍵角為______________,中心原子的雜化形式為_________。
(4)X的氫化物的沸點比同主族其他元素形成的氫化物沸點高,原因是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳鈷錳三元材料是近年來開發的一類新型鋰離子電池正極材料,具有容量高、循環穩定性好、成本適中等重要優點。鎳鈷錳三元材料中Ni為主要活潑元素,通常可以表示為:LiNiaCobMncO2,其中a+b+c=1,可簡寫為LiAO2。充電時總反應為LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下圖所示,則以下說法正確的是( )
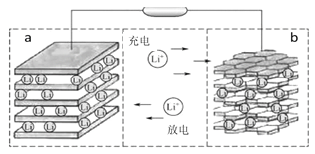
A. 放電時Ni元素最先失去電子
B. 放電時電子從a電極由導線移向b電極
C. 充電時的陽極反應式為LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充電時轉移1mol電子,理論上陰極材料質量增加7g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水三氯化鉻(CrCl3)為紫色晶體,在工業上主要用作媒染劑和催化劑,某化學小組用Cr2O3和CCl4在高溫下制備無水三氯化鉻,部分實驗裝置如圖所示。
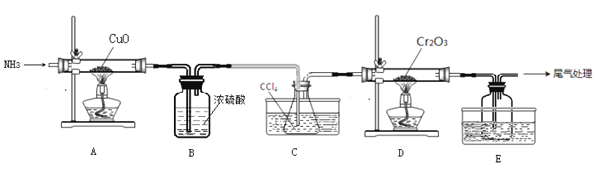
已知:①CrCl3熔點為83℃,易潮解,易升華,易溶于水但不易水解,高溫下易被氧氣氧化;②Cr2O3和CCl4在高溫下反應的產物為CrCl3和光氣(COCl2 )。請回答下列問題:
(1)裝置A是氮氣制備裝置,氮氣的作用是____________。
(2)裝置B的作用為________。裝置C和裝置E的水槽中應分別盛有__________、____________。
(3)裝置D中生成CrCl3和光氣(COCl2 )的化學方程式為_________。
(4)該實驗裝置有設計不合理的地方,請寫出改進方法:_________(寫一點即可)
(5)產品中CrCl3質量分數的測定:
(i)稱取0.3000 g得到的CrCl3樣品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL樣品溶液于帶塞的錐形瓶中,加熱至沸騰后加入稍過量的Na2O2,稀釋并加熱煮沸,再加入過量的H2SO4酸化,將Cr3+氧化為Cr2O72-;再加入過量的KI固體,加塞搖勻,使鉻完全以Cr3+形式存在
(iii)加入1mL指示劑,用0.0250 mol·L-1標準Na2S2O3溶液滴定至終點,平行測定三次,平均消耗標準Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍過量的Na2O2后要加熱煮沸,其主要原因是____________;加入KI發生反應的離子方程式為________________
②滴定實驗可選用的指示劑為____________產品中CrCl3質量分數為_______%(結果保留兩位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,濃度均為0.1 mol·L-1、體積均為100 mL的兩種一元酸HX、HY的溶液中,分別加入NaOH固體,lg[c(H+)/c(OH-)]隨加入NaOH的物質的量的變化如圖所示。下列敘述正確的是( )
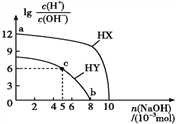
A. HX的酸性弱于HY B. c點溶液中:c(Y-)>c(HY)
C. a點由水電離出的c(H+)=10-12 mol·L-1 D. b點時酸堿恰好完全中和
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列框圖涉及的物質所含元素中,除一種元素外,其余均為1~18號元素。

已知:A、F為無色氣體單質,B為具有刺激性氣味的氣體,化學家哈伯因合成B獲得1918年的諾貝爾化學獎。C為黑色氧化物,E為紫紅色金屬單質,I為藍色沉淀(部分反應的產物未列出)。請回答下列問題:
(1)常溫下鋁遇到G的濃溶液后表面形成一層致密的保護膜,該現象稱為___________。
(2)E與G的稀溶液反應的離子方程式為_________。
(3)在25 ℃和101 kPa的條件下,將VL的B氣體溶于100 mL水中,得到密度為ρg·mL-1的溶液M,則M溶液的物質的量濃度為________ mol·L-1。(已知25 ℃、101 kPa條件下氣體摩爾體積為24.5 L·mol-1,不必化簡)
(4)分別蘸取B的濃溶液和G的濃溶液的玻璃棒,接近后的現象是_________。
(5)B和C反應的化學方程式為__________。
(6)J、K是同種金屬的不同氯化物,K為白色沉淀。寫出SO2還原J生成K的離子方程式:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、Q、R皆為前20號元素,其原子半徑與主要化合價的關系如圖所示。下列說法錯誤是

A. Q位于第三周期IA族
B. X、Y、Z三種元素組成的化合物可能是鹽或堿
C. 簡單離子半徑:M->Q+>R2+
D. Z與M的最高價氧化物對應水化物均為強酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的氧化物(NOx)是大氣主要污染物,有效去除大氣中的NOx是環境保護的重要課題。
(1)N2O又稱笑氣,有輕微的麻醉作用,N2O在一定條件下可分解為N2、O2。回答下列問題:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJmol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJmol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJmol-1
則反應2N2O(g)=2N2(g)+O2(g) △H=_______ kJmol-1
(2)汽車尾氣中的NO和CO可在催化劑作用下生成無污染的氣體而除去。在密閉容器中充入10molCO和8molNO發生反應,測得平衡時NO的體積分數與溫度、壓強的關系如下圖

①已知T2>T1,則反應2NO(g)+2CO(g)![]() 2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
②該反應達到平衡后,為同時提高反應速率和NO的轉化率,可采取的措施有____(填字母序號)
a.改用高效催化劑 b.縮小容器的體積 c.增加CO的濃度 d.升高溫度
③壓強為10MPa、溫度為T1下,若反應進行到20min達到平衡狀態,此時容器的體積為4L,則用N2的濃度變化表示的平均反應速率v(N2)=____,該溫度下用分壓表示的平衡常數Kp= ___MPa-1(分壓=總壓×物質的量分數)。
④在D點,對反應容器升溫的同時擴大體積至體系壓強減小,重新達到的平衡狀態可能是圖中A~G點中____點。
(3)在有氧條件下,新型催化劑M能催化NH3與NOx反應生成N2,將一定比例的O2、NH3和NOx的混合氣體勻速通入裝有催化劑M的反應器中反應,反應相同時間,NOx的去除率隨反應溫度的變化曲線如圖所示。

①在50℃~150℃范圍內隨溫度升高,NOx的去除率迅速上升的原因是____。
②當反應溫度高于380℃時,NOx的去除率迅速下降的原因可能是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com