
(7分)在一個密閉容器中,有一個左右可滑動隔板,兩邊分別進行可逆反應,各物質的量如下:M、N、P為2.5mol、3.0mol、1.0mol。A、C、D各為0.50mol,B的物質的量為x,當x的物質的量在一定范圍內變化,均可以通過調節反應器的溫度,使兩側反應均達到平衡,且隔板在反應器的正中位置。達到平衡后,測得M的轉化率為75%,填寫空白:
(1)達到平衡后,反應器左室氣體總的物質的量為 mol。
(2)若要使右室反應開始時V正>V逆,x的取值范圍 。
(3)若要使右室反應開始時V正<V逆,x的取值范圍 。
(1)3.5mol (1分) (2)2.0<x<3.0 (3分) (3)1.5<x<2.0(3分)
解析試題分析:(1)方法一:在左室反應2M(g)+3N(s) 2P(g)中,開始時,M、N、P為2.5mol、3.0mol、1.0mol。達到平衡后,測得M的轉化率為75%,則平衡時M:2.5mol×25%=0.625mol;P: 2.5mol×75%+1.0mol=2.875mol.所以氣體的總物質的量是2.875mol+0.625mol=3.5mol。方法二:由于該反應是反應前后氣體體積相等的反應,所以達到平衡時與反應開始時氣體的物質的量相等,因此平衡時氣體的物質的量是2.5mol+1.0mol=3.5mol。(2)若要使右室反應開始時V正>V逆,且隔板在反應器的正中位置x的取值范圍是0.50mol×3+x>3.50mol;x>2mol;若反應是完全從正反應方向開始的,C、D的物質不是加入的,認為是反應消耗A、B生成的,則根據反應方程式中各種物質的物質的量的關系可知,會消耗B物質1mol,則B的最大物質的量是2+1=3mol,故若要使右室反應開始時V正>V逆,x的取值范圍是2.0mol<x<3.0mol。(3)若要使右室反應開始時V正<V逆,即反應逆向進行,由于平衡時氣體的物質的量是3.50mol, 0.50mol×3+x≤3.50mol;所以x最大值是2.0mol,若使反應逆向進行,反應是逆向開始的,則每反應消耗2mol的C和1mol的D,有1mol的A產生,4mol的B產生,就會現在產生0.50mol的A,則消耗C的物質的量是0.50mol,消耗D是0.250mol ,產生A 0.250mol,產生B1mol;還有D0.250mol則x+0.750mol+1mol+0.25=3.50mol,解得x=1.50mol。因此開始時B的物質的量是2mol-1mol=1mol,故相應的B的取值范圍是1.5<x<2.0。
2P(g)中,開始時,M、N、P為2.5mol、3.0mol、1.0mol。達到平衡后,測得M的轉化率為75%,則平衡時M:2.5mol×25%=0.625mol;P: 2.5mol×75%+1.0mol=2.875mol.所以氣體的總物質的量是2.875mol+0.625mol=3.5mol。方法二:由于該反應是反應前后氣體體積相等的反應,所以達到平衡時與反應開始時氣體的物質的量相等,因此平衡時氣體的物質的量是2.5mol+1.0mol=3.5mol。(2)若要使右室反應開始時V正>V逆,且隔板在反應器的正中位置x的取值范圍是0.50mol×3+x>3.50mol;x>2mol;若反應是完全從正反應方向開始的,C、D的物質不是加入的,認為是反應消耗A、B生成的,則根據反應方程式中各種物質的物質的量的關系可知,會消耗B物質1mol,則B的最大物質的量是2+1=3mol,故若要使右室反應開始時V正>V逆,x的取值范圍是2.0mol<x<3.0mol。(3)若要使右室反應開始時V正<V逆,即反應逆向進行,由于平衡時氣體的物質的量是3.50mol, 0.50mol×3+x≤3.50mol;所以x最大值是2.0mol,若使反應逆向進行,反應是逆向開始的,則每反應消耗2mol的C和1mol的D,有1mol的A產生,4mol的B產生,就會現在產生0.50mol的A,則消耗C的物質的量是0.50mol,消耗D是0.250mol ,產生A 0.250mol,產生B1mol;還有D0.250mol則x+0.750mol+1mol+0.25=3.50mol,解得x=1.50mol。因此開始時B的物質的量是2mol-1mol=1mol,故相應的B的取值范圍是1.5<x<2.0。
考點:考查物質的量對可逆反應平衡的影響的知識。


科目:高中化學 來源: 題型:單選題
某反應中,X、Y、Z三種物質的物質的量隨時間的變化如圖所示。下列說法正確的是
| A.反應為 X + 2Z= Y |
B.反應為 X + Y 2Z 2Z |
| C.4 s 時,反應達到平衡 |
| D.12 s 時,反應不再進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
某可逆反應L(s) + G(g)  3R(g) △H>0,下圖表示外界條件溫度、壓強的變化對上述反應的影響。試判斷圖中y軸可以表示( )
3R(g) △H>0,下圖表示外界條件溫度、壓強的變化對上述反應的影響。試判斷圖中y軸可以表示( )
| A.平衡混合氣中R的質量分數 | B.達到平衡時G的轉化率 |
| C.平衡混合氣中G的質量分數 | D.達到平衡時L的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(8分)(1)氫是未來最好的能源選擇,制取氫氣的成熟的方法有很多,利用甲醇可以與水蒸氣反應生成氫氣,反應方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g)
CO2(g) + 3H2(g) 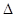 H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
一定條件下,向容積為2L的恒容密閉容器中充入1 mol CH3OH(g)和3 mol H2O(g),實驗測得:達到平衡狀態時,吸收熱量19.76 kJ。則
①達平衡時混合氣體的壓強是反應前的 倍。
②該條件下的該反應的平衡常數是 (結果保留兩位有效數字)。
③該條件下反應達平衡狀態的依據是(填序號) 。
| A.v正(CH3OH)=v正(CO2) | B.混合氣體的密度不變 |
| C.c(CH3OH)=c(H2O) | D.混合氣體的總物質的量不變 |
 2SO3(g)
2SO3(g) 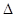 H<0,甲、乙起始反應溫度相同,均和外界無熱量交換,平衡時,甲中SO2的轉化率為a,乙中SO3的分解率為b,則a、b的關系為a+b _______ 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反應溫度相同,均和外界無熱量交換,平衡時,甲中SO2的轉化率為a,乙中SO3的分解率為b,則a、b的關系為a+b _______ 1(填“﹤”、“﹥”或“=”) 。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分) )氮元素有著多變價態和種類繁多的化合物,因在生產、生活中發揮著重要的作用。完成下列問題:
(1)在一密閉容器中,進行如下化學反應:
N2(g)+3H2(g) 2NH3(g) △H<0,其化學平衡常數K與溫度T的關系如下表:
2NH3(g) △H<0,其化學平衡常數K與溫度T的關系如下表:
| T | 298 K | 398 K | 498 K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
2014年初霧霾天氣多次肆虐我國中東部地區。其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一。
(1)汽車尾氣凈化的主要原理為2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線如圖所示。據此判斷:
2CO2(g)+N2(g)。在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線如圖所示。據此判斷:
①該反應在 能自發進行(填“高溫下” 、“低溫下” 或“任何溫度下”);
②在T2溫度下,0~2 s內的平均反應速率v(N2)=___________。
(2)煤燃燒產生的煙氣含氮的氧化物,用CH4催化還原NOx可以消除氮氧化物的污染。
在恒壓下,將CH4(g)和NO2(g)置于密閉容器中,也可以發生化學反應:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2轉化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2轉化率的措施有
| A.增加原催化劑的表面積 | B.降低溫度 |
| C.減小投料比[n(NO2) / n(CH4)] | D.增大壓強 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(11分)
(1)在一密閉的2 L的容器里充入8 mol SO2和4 mol18O2,在一定條件下開始反應:
2SO2(g)+O2(g) 2SO3(g)2 min末測得容器中有7.2 mol SO2。試回答:
2SO3(g)2 min末測得容器中有7.2 mol SO2。試回答:
①反應后18O原子存在于哪些物質中________
②2 min末SO3的濃度為________
③用O2的濃度變化表示該時間段內的化學反應速率為________
(2)基本化工原料苯和乙烯,都有著十分廣泛的用途。請回答:
①可以用來鑒別苯蒸氣和乙烯的試劑是________(填序號)
A.水 B.溴的四氯化碳溶液 C.酸性高錳酸鉀溶液 D.氫氣
②苯分子具有平面正六邊形結構,所有原子共平面,則苯分子中在一條直線上的原子最多有________個
(3)下列營養物質在人體內發生的變化及其對人的生命活動所起的作用不正確的是
A.人體中的糖類、油脂和蛋白質都能為人的生命活動提供能量
B.淀粉和纖維素 葡萄糖
葡萄糖 CO2和H2O(釋放能量維持生命活動)
CO2和H2O(釋放能量維持生命活動)
C.油脂 甘油和高級脂肪酸
甘油和高級脂肪酸 CO2和H2O(釋放能量維持生命活動)
CO2和H2O(釋放能量維持生命活動)
D.蛋白質 氨基酸
氨基酸 人體所需的蛋白質(人體生長發育、新陳代謝)
人體所需的蛋白質(人體生長發育、新陳代謝)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分)科學家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理為:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H="-92.4" kJ/mol,該反應的能量變化如圖所示。
H="-92.4" kJ/mol,該反應的能量變化如圖所示。
①在反應體系中加入催化劑,反應速率增大,E2的變化是 (填“增大”、“減小”或“不變”)。
②將0.3 mol N2和0.5 mol H2充入體積不變的密閉容器中,在一定條件下達到平衡,測得容器內氣體壓強變為原來的 ,此時H2的轉化率為 (計算出結果);欲提高該容器中H2的轉化率,下列措施可行的是 (填選項字母)。
,此時H2的轉化率為 (計算出結果);欲提高該容器中H2的轉化率,下列措施可行的是 (填選項字母)。
| A.向容器中按原比例再充入原料氣 | B.向容器中再充入一定量H2 |
| C.改變反應的催化劑 | D.液化生成物分離出氨 |
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H="+1530" kJ/mol
H="+1530" kJ/mol H="+44.0" kJ/mol
H="+44.0" kJ/mol 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H = kJ/mol,該反應的化學平衡常數表達式為K= ,控制其他條件不變,增大壓強,K值 (填“增大”、“減小”或“不變”)。
H = kJ/mol,該反應的化學平衡常數表達式為K= ,控制其他條件不變,增大壓強,K值 (填“增大”、“減小”或“不變”)。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硫酸的消費量是衡量一個國家化工生產水平的重要標志。
(1)一定條件下,SO2與空氣反應10 min后,SO2和SO3物質的量濃度分別為1.2 mol/L和2.0 mol/L,則SO2起始物質的量濃度為______;生成SO3的化學反應速率為______。
(2)若改變外界條件,發生SO2與空氣反應生成SO3,使10 min內的用O2表示的反應速率為0.15mol/(L·min),則改變的條件可能是_______________。
| A.壓縮體積,增大壓強 | B.降低溫度 | C.充入大量的氮氣 | D.僅增加SO2的濃度 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com