
| A. | △H1-△H2<0 | |
| B. | 反應②為放熱反應 | |
| C. | 3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g)△H=-103.0 kJ•mol-1 | |
| D. | 3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g)△H=-301.3kJ•mol-1 |
分析 A.△H1-△H2為$\frac{1}{2}$O2(g)+H2(g)=H2O(g)的反應熱;
B.反應②:C(s)+H2O(g)=CO(g)+H2(g)為吸熱反應;
C.根據蓋斯定律可得3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g)△H=340.0 kJ•mol-1;
D.根據蓋斯定律可得3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g)△H=-301.3kJ•mol-1.
解答 解:A.△H1-△H2為:$\frac{1}{2}$O2(g)+H2(g)=H2O(g)化合反應,為放熱反應,故A正確;
B.反應②:C(s)+H2O(g)=CO(g)+H2(g)為吸熱反應,故B錯誤;
C.根據蓋斯定律:⑤×2-④×3得3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g)△H=340.0 kJ•mol-1,故C錯誤;
D.根據蓋斯定律:③×3+⑤得3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g)△H=-301.3kJ•mol-1,故D正確.
故選AD.
點評 本題考查了熱化學方程式的書寫方法和蓋斯定律的應用,注意物質狀態的標注和焓變的計算,題目難度不大.


科目:高中化學 來源: 題型:解答題
 隨著能源與環境問題越來越被人們關注,碳一化學(C1化學)成為研究的熱點..“碳一化學”即以單質碳及CO、CO2、CH4、CH3OH等含一個碳原子的物質為原料合成工業產品的化學與工藝.(1)將CO2轉化成有機物可有效實現碳循環.CO2轉化成有機物的例子很多,如:
隨著能源與環境問題越來越被人們關注,碳一化學(C1化學)成為研究的熱點..“碳一化學”即以單質碳及CO、CO2、CH4、CH3OH等含一個碳原子的物質為原料合成工業產品的化學與工藝.(1)將CO2轉化成有機物可有效實現碳循環.CO2轉化成有機物的例子很多,如:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 鐵與稀鹽酸反應:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 鋅與硫酸銅溶液反應:Zn+Cu2+=Zn2++Cu | |
| C. | 碳酸鈣與稀鹽酸反應:CaCO3+2H +=Ca2++H2O+CO2↑ | |
| D. | 硫酸和氫氧化鋇溶液反應:Ba2++SO42-+H++OH-=H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
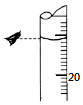 某同學欲用物質的量濃度為0.100 0mol•L-1的鹽酸測定未知物質的量濃度的氫氧化鈉溶液,選擇酚酞作指示劑.請填寫下列空白:
某同學欲用物質的量濃度為0.100 0mol•L-1的鹽酸測定未知物質的量濃度的氫氧化鈉溶液,選擇酚酞作指示劑.請填寫下列空白:| 滴定 次數 | 待測溶液 體積/mL | 標準酸體積 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 10.00 | 1.34 | 19.39 |
| 第二次 | 10.00 | 4.10 | 21.10 |
| 第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 容器編號 | n(B)/mol | n(C)/mol | n(D)/mol | 反應時間/min | 反應速率 |
| Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
| Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
| Ⅲ | 0.32 | 1.0 | 0 | 0 | |
| Ⅳ | 0.12 | 0.30 | v(正)=v(逆) |
| A. | 容器Ⅳ中c(D)=0.4 mol/L | |
| B. | t2時容器Ⅱ中v(正)>v(逆) | |
| C. | 容器Ⅰ中平均反應速率v(B)=$\frac{0.04}{{t}_{1}}$mol/(L•min) | |
| D. | 容器Ⅲ中反應至平衡時吸熱20 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④⑥⑦⑧ | B. | ①③⑦ | C. | ①③④⑤⑥⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com