
【題目】某化學小組利用硫代硫酸鈉進行了相關的實驗。
Ⅰ.已知:Na2S2O3+H2 SO4 Na2SO4+SO2↑+S↓+H2O,某同學探究影響硫代硫酸鈉與稀硫酸反應速率的因素時,設計了如下系列實驗:
實驗序號 | 反應溫度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)該實驗①、②可探究溫度對反應速率的影響,因此V1=V2=____,V3=___;
(2)若V4=10.0,V5=6.0,則實驗①、③可探究_____對反應速率的影響。
Ⅱ.利用反應:I2+2Na2S2O3 Na2S4O6+2NaI可定量測定硫代硫酸鈉(Mr=158)的純度,現在稱取wg硫代硫酸鈉固體樣品,配成250mL的溶液,取25.00mL置于錐形瓶中,加入指示劑,用amol/L的碘水滴定,消耗碘水b mL,則:
(3)滴定時,將碘水注入___(填“酸式”或“堿式”)滴定管中,滴定應選擇的指示劑是____,滴定終點的現象為________。
(4)對于該滴定實驗的有關操作或誤差分析正確的是____。
a.滴定前,要用對應裝入的溶液潤洗錐形瓶和滴定管
b.滴定過程中,標準液滴到錐形瓶外,會使所測得的結果偏大
c.滴定開始時滴定管尖嘴有氣泡,滴定結束后氣泡消失,測得純度將偏小
d.滴定前仰視讀數而滴定結束時平視讀數,則所測得的純度將會偏小
(5)樣品中硫代硫酸鈉純度的表達式為____。
【答案】10.0 0 濃度 酸式滴定管 淀粉 當滴入最后一滴碘水時,溶液剛好出現藍色,且半分鐘不褪去 bd ![]() ×100%
×100%
【解析】
Ⅰ、(1)由表中所給數據可知:實驗①、②溫度不同故實驗①、②則是探究溫度對反應速率影響,則V1=10.0ml,V2=10.0ml;V3=0ml;
(2)實驗①、③溫度相同,所取稀硫酸量不同,故實驗①、③則是探究濃度對反應速率影響;
Ⅱ、(3)碘具有氧化性能腐蝕橡膠,滴定時,將碘水注入酸式滴定管中,淀粉遇碘變藍,故應用淀粉作指示劑;滴定終點現象為:當滴入最后一滴碘水時,溶液剛好出現藍色,且半分鐘不褪去;
(4)a、錐形瓶不應潤洗,若用待裝液潤洗,則會導致消耗碘水體積偏大,故所配溶液濃度偏大,a項錯誤;
b.滴定過程中,標準液滴到錐形瓶外,則會導致所讀體積偏大,會使所測結果偏大,b正確
c.滴定管在滴定開始時尖嘴有氣泡,滴定完成后氣泡消失,則會使消耗溶液體積偏大,故會使最終結果偏高,c錯誤;
d.滴定前仰視讀數而滴定結束時俯視讀數,則會導致滴定所讀數據偏小,故會導致所得結果偏低,d正確;
答案選bd;
(5)由題中所給數據可知樣品中硫代硫酸鈉純度的表達式為![]() ×100%。
×100%。


 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:
【題目】甲烷水蒸氣重整制取的合成氣可用于熔融碳酸鹽燃料電池。
(1)制取合成氣的反應為CH4(g)+H2O(g)![]() CO(g)+3H2(g)H =+206 kJ/mol。
CO(g)+3H2(g)H =+206 kJ/mol。
向體積為2 L密閉容器中,按n(H2O)∶n(CH4)=1投料:
a.保持溫度為T1時,測得CH4(g)的濃度隨時間變化曲線如圖1所示。
b.其他條件相同時,在不同催化劑(Ⅰ、Ⅱ、Ⅲ)作用下,反應相同時間后,CH4的轉化率隨反應溫度的變化如圖2所示。

①結合圖1,寫出反應達平衡的過程中的能量變化:______kJ。
②在圖1中畫出:起始條件相同,保持溫度為T2(T2> T1)時, c(CH4)隨時間的變化曲線______。
③根據圖2判斷:
ⅰ. a點所處的狀態不是化學平衡狀態,理由是_______。
ⅱ. CH4的轉化率:c>b,原因是________。
(2)熔融碳酸鹽燃料電池的結構示意圖如下。

①電池工作時,熔融碳酸鹽中CO32-移向________(填“電極A”或“電極B”)
②寫出正極上的電極反應:________。
(3)若不考慮副反應,1 kg甲烷完全轉化所得到的合成氣全部用于燃料電池中,外電路通過的電子的物質的量最大為_____mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某MCFC型燃料電池可同時供應電和水蒸汽,其工作溫度為600℃~700℃,所用燃料為氫氣,電解質為熔融的K2CO3。該電池的總反應為:2H2+O2=2H2O,負極電極反應式為: H2+CO32——2e—![]() H2O+CO2。則下列判斷中正確的是
H2O+CO2。則下列判斷中正確的是
A.放電時CO32—向負極移動
B.放電時CO32—向正極移動
C.正極反應: 4OH——4e—=2H2O+O2↑
D.當電池中生成1 mol水時,轉移4 mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】尿素![]() 是一種重要的化工產品,工業生產尿素的主要流程如下:
是一種重要的化工產品,工業生產尿素的主要流程如下:
![]()
(1)工業合成氨的化學方程式是_______。
(2)尿素分子中C、N原子間的共用電子對偏向N原子,從原子結構的角度解釋原因:______。
(3)由NH3和CO2合成尿素分為兩步反應(均為可逆反應),其能量變化示意圖如下:
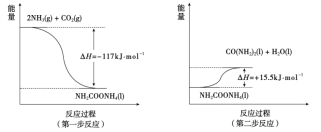
①合成尿素總反應的熱化學方程式是_______。
②粗尿素中含有NH2COONH4雜質。通過控制溫度和壓強,可將NH2COONH4分解為NH3和CO2。研究溫度和壓強對NH2COONH4分解率的影響,結果如下:
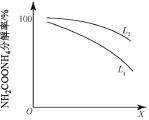
X代表_____(填“溫度”或“壓強”),L1_____L2(填“>”或“<”)。
(4)工業上含尿素的廢水需經處理后才能排放。一種利用電化學方法降解尿素的裝置示意圖如下:
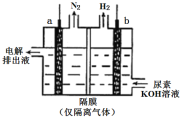
寫出尿素被降解的電極反應式是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校學生用下圖所示裝置進行實驗。以探究苯與溴發生反應的原理并分離提純反應的產物。

請回答下列問題:
(1)寫出裝置Ⅱ中發生的主要化學反應方程式____________________________,其中冷凝管所起的作用為導氣和________,Ⅳ中球形干燥管的作用是__________。
(2)實驗開始時,關閉K2、開啟K1和分液漏斗活塞,滴加苯和液溴的混合液,反應開始。Ⅲ中小試管內苯的作用是_________________________。
(3)能說明苯與液溴發生了取代反應的現象是______________________。
(4)反應結束后,要讓裝置Ⅰ中的水倒吸入裝置Ⅱ中以除去裝置Ⅱ中殘余的HBr氣體。簡述如何實現這一操作:______________________________________。
(5)純凈的溴苯是無色油狀的液體,這個裝置制得的溴苯呈紅棕色,原因是里面混有______________,將三頸燒瓶內反應后的液體依次進行下列實驗操作就可得到較純凈的溴苯。①用蒸餾水洗滌,振蕩,分液;②用__________洗滌,振蕩,分液;③蒸餾。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在常溫下的一密閉容器中事先放入1.56g過氧化鈉,然后再通入乙烷與氧氣的混合氣體,用電火花引爆,直至反應完全為止,恢復到原溫度,容器內壓強近似為零。
(1)相同條件下,通入的氣體氧氣和乙烷的體積比是多少?_____
(2)通入氧氣的質量最大應是多少?_____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】LED產品的使用為城市增添色彩。下圖是氫氧燃料電池驅動LED發光的一種裝置示意圖。下列有關敘述正確的是
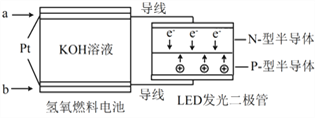
A. a處通入氧氣, b處通氫氣
B. 通入H2的電極發生反應:H2-2e- = 2H+
C. 通入O2的電極發生反應:O2 + 4e- + 2H2O = 4OH-
D. 該裝置將化學能最終轉化為電能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在![]() H、
H、![]() H、
H、![]() H、
H、![]() Mg、
Mg、![]() Mg和
Mg和![]() Cu中共有____種元素,_____種原子。
Cu中共有____種元素,_____種原子。
(2)有下列各組物質:A.O2和O3 B.12C和13C C.CH3—CH2—CH2—CH3和![]() D.
D.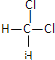 和
和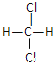 E.甲烷和庚烷。
E.甲烷和庚烷。
①_________組兩物質互為同位素。
②__________組兩物質互為同素異形體。
③_________組兩物質屬于同系物。
④_________組兩物質互為同分異構體。
⑤_________組中兩物質是同一物質。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綠原酸(C16H18O9)具有較廣泛的抗菌、抗病毒、抗氧化作用,利用乙醚、60%乙醇浸泡杜仲干葉,得到提取液,進一步獲得綠原酸粗產品的一種工藝流程如圖,下列說法錯誤的是( )
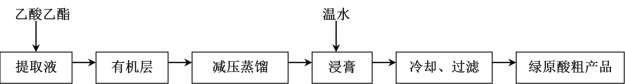
A.綠原酸在溫水中的溶解度小于冷水中的溶解度
B.得到有機層的實驗操作為萃取分液
C.減壓蒸餾的目的防止溫度過高,綠原酸變質
D.綠原酸粗產品可以通過重結晶進一步提純
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com