
許多硫的含氧酸鹽在醫藥、化工等方面有著重要的用途。
(1)重晶石(BaSO4)常做胃腸道造影劑。已知:常溫下,Ksp(BaSO4)=1.1×10-10。向BaSO4懸濁液中加入硫酸,當溶液的pH=2時,溶液中c(Ba2+)= ;
(2)硫酸亞鐵銨晶體[(NH4)2Fe(SO4)2·6H2O]常做分析劑。等物質的量濃度的四種稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中c(NH4+)由大到小的順序為 (填選項字母);
(3)過二硫酸鉀(K2S2O8)常做強氧化劑,Na2S2O3常做還原劑。
①K2S2O8溶液與酸性MnSO4溶液混合,在催化劑作用下,可以觀察到溶液變為紫色,該反應的離子方程式為 ;
②樣品中K2S2O8的含量可用碘量法測定。操作步驟為稱取0.3000 g樣品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固體(稍過量),振蕩使其充分反應;加入適量醋酸溶液酸化,以 為指示劑,用0.1000 mol·L-1 Na2S2O3標準液滴定至終點(已知:I2+2S2O32- = 2I-+S4O62-)。重復2次,測得平均消耗標準液21.00 mL。該樣品中K2S2O8的質量分數為(雜質不參加反應) _(結果保留三位有效數字)。
(1)2.2×10-8mol/L( 未寫單位不得分) (2)a>c>d>b
(2)①5S2O32-+2Mn2++8H2O 10SO42-+2MnO4-+16H+ (沒寫反應條件給分)
10SO42-+2MnO4-+16H+ (沒寫反應條件給分)
②淀粉 94.5%
【解析】
試題分析:(1)Ksp(BaSO4)=1.1×10-10,當溶液的pH=2時,c(SO42-) =0.005 mol/L ,c(Ba2+)= Ksp(BaSO4)/ c(SO42-)=2.2×10-8mol/L ;
(2)等物質的量濃度的四種稀溶液:
a.(NH4)2Fe(SO4)2 ,c.(NH4)2SO4 ,d.(NH4)2SO3 中NH4+濃度大于b.NH4HSO4 ,a.Fe2+ 和NH4+水解相互抑制,d. NH4+和SO32-水解相互促進。所以c(NH4+)由大到小的順序為a>c>d>b;
(3)過二硫酸鉀(K2S2O8)常做強氧化劑,①K2S2O8溶液與酸性MnSO4溶液混合,在催化劑作用下,可以觀察到溶液變為紫色,Mn2+被氧化成MnO4-,S2O82-被還原,5S2O32-+2Mn2++8H2O 10SO42-+2MnO4-+16H+,②因為該反應涉及I2,可以用淀粉溶液作指示劑;由I2+2S2O32- = 2I-+S4O62- 得關系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100℅=94.5%
10SO42-+2MnO4-+16H+,②因為該反應涉及I2,可以用淀粉溶液作指示劑;由I2+2S2O32- = 2I-+S4O62- 得關系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100℅=94.5%
考點:溶度積常數的計算及氧化還原反應的分析和計算


科目:高中化學 來源:2015屆河北省邯鄲市高二上學期期末考試化學試卷(解析版) 題型:選擇題
下列措施不能達到節能減排目的的是
A.利用太陽能制氫燃料 B.用家用汽車代替公交車
C.利用潮汐能發電 D.用節能燈代替白熾燈
查看答案和解析>>
科目:高中化學 來源:2015屆江西贛州市高二上學期期末聯考化學試卷(解析版) 題型:選擇題
已知可逆反應:M(g)+N(g) P(g)+Q(g) △H>0 。反應達到平衡后,若要增大M的轉化率,在其它條件不變的情況下可以采取的措施為( )
P(g)+Q(g) △H>0 。反應達到平衡后,若要增大M的轉化率,在其它條件不變的情況下可以采取的措施為( )
①加入一定量的M ②加入一定量的N ③升高反應體系的溫度 ④縮小容器體積
⑤加入某物質作催化劑 ⑥分離出一定量的P
A.① ③ ⑤ B.② ④ ⑥ C.② ③ ⑥ D.④ ⑤ ⑥
查看答案和解析>>
科目:高中化學 來源:2015屆江西省贛州市六校高二上學期期末聯考化學試卷(解析版) 題型:選擇題
可逆反應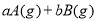

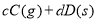
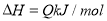 ,反應過程中,當其他條件不變時,C在混合物中的含量與溫度(T)的關系如圖I所示,反應速率(v)與壓強(p)的關系如圖II所示。據圖分析,以下說法正確的是( )
,反應過程中,當其他條件不變時,C在混合物中的含量與溫度(T)的關系如圖I所示,反應速率(v)與壓強(p)的關系如圖II所示。據圖分析,以下說法正確的是( )
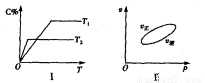
A.T1<T2,Q>0
B.增大壓強,物質B的轉化率增大
C.反應達平衡后,增加少量的D,平衡逆向移動
D.a+b>c+d
查看答案和解析>>
科目:高中化學 來源:2015屆江西省贛州市六校高二上學期期末聯考化學試卷(解析版) 題型:選擇題
能說明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )
①稀釋時,溶液中c(OH-)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2-)
④溶液可與等體積等物質的量濃度的NaOH溶液恰好反應
A.①②④ B.①③④ C.①③ D.②④
查看答案和解析>>
科目:高中化學 來源:2015屆江西省新余市高二上學期期末考試化學試卷(解析版) 題型:填空題
北京時間2013年12月2日凌晨1時30分,我國的“嫦娥三號”月球探測器在西昌衛星發射中心發射升空,發射“嫦娥三號”月球探測器的火箭推進器中裝有還原劑肼(N2H4)和氧化劑N2O4,當它們混合時,即產生大量的氮氣和水蒸氣,并放出大量的熱。已知0.4 mol氣態肼和足量N2O4氣體反應生成氮氣和水蒸氣時放出219.3 kJ的熱量。
(1)寫出肼和N2O4反應的熱化學方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,則16 g氣態肼與足量N2O4氣體反應生成氮氣和液態水時,放出的熱量是 ;
(3)肼除應用于火箭燃料外,還可作為燃料電池的燃料,由肼和空氣構成的堿性燃料電池的負極反應式為: ,正極反應式為: ;
(4)向次氯酸鈉溶液中通入一定物質的量的氨氣可生成肼,寫出反應的離子方程式: 。
查看答案和解析>>
科目:高中化學 來源:2015屆江西省新余市高二上學期期末考試化學試卷(解析版) 題型:選擇題
水是一種極弱的電解質,在室溫下,KW=1×10-14,則此時水的電離百分數為:
A.1×10-7 B.1/55.6 C.10-14 D. 1/(55.6×107)
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省教學協作體高二上學期期末化學試卷(解析版) 題型:選擇題
下列溶液中的Cl?濃度與100 mL 1 mol ·L-1 MgCl2溶液中的Cl?濃度相等的是
A.150 mL 1 mol·L-1 AlCl3溶液 B.75 mL 0.5mol·L-1 CaCl2溶液
C.150 mL 0.75 mol·L-1 CaCl2溶液 D.75 mL 2 mol ·L-1NaCl 溶液
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省揚州市高二下學期學業水平模擬化學試卷(二)(解析版) 題型:選擇題
下列物質中既含有共價鍵又含離子鍵的化合物是
A.MgCl2 B.NaOH C.K2O D.C6H6
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com