
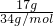 =0.5mol,完全分解的化學方程式為:2H2O2=2H2O+O2↑,2molH2O2分解O元素的化合價從-1價變化為0價和-2價,電子轉移數為2mol,所以0.5mol過氧化氫分解電子轉移為0.5mol,即0.5NA,故D錯誤;
=0.5mol,完全分解的化學方程式為:2H2O2=2H2O+O2↑,2molH2O2分解O元素的化合價從-1價變化為0價和-2價,電子轉移數為2mol,所以0.5mol過氧化氫分解電子轉移為0.5mol,即0.5NA,故D錯誤;

科目:高中化學 來源: 題型:
 已知CsCl晶體的密度為ρg/cm3,NA為阿伏加德羅常數,相鄰的兩個Cs+的核間距為a cm,如圖所示,則CsCl的相對分子質量可以表示為( )
已知CsCl晶體的密度為ρg/cm3,NA為阿伏加德羅常數,相鄰的兩個Cs+的核間距為a cm,如圖所示,則CsCl的相對分子質量可以表示為( )
|
|
|
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com