

| 步驟 | 實驗操作 | 實驗現象 | 實驗結論 |
| Ⅰ | 打開活塞a,逐滴加入H2SO3溶液至過量 | 燒瓶內溶液由橙黃色變為無色 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步驟Ⅰ所得溶液中逐滴加入H2O2溶液 | 剛開始溶液顏色無明顯變化,繼續滴加,溶液變為橙黃色 | H2O2的氧化性大于Br2 |

分析 本題是利用自發的氧化還原反應中氧化劑的氧化性大于氧化產物的原理設計實驗,探究H2O2、H2SO3、Br2氧化性強弱,涉及識別儀器A的名稱,結合反應原理分析實驗過程中可能出現的現象,并用離子方程式表示反應原理,另外還考查了氯堿工業制氯氣的原理;
(1)反應容器上方儀器A的作用是冷凝逸出的蒸汽,可常見儀器識別出A的名稱;
(2)根據結論Br2的氧化性大于H2SO3可知,溴水有強氧化性,能氧化H2SO3,隨著H2SO3溶液逐滴加入,溶液里溴的量逐漸減小,混合溶液的顏色會變淺直到褪色,向步驟Ⅰ所得的反應溶液里逐滴加入H2O2溶液,溶液又變為橙黃色,可見溶液里的Br-又被氧化為Br2,說明的H2O2氧化性大于Br2;
(3)因為步驟Ⅰ滴加的H2SO3溶液是過量的,開始滴入H2O2溶液時沒有直接氧化溶液里的Br-,而是先與過量的H2SO3發生了氧化還原反應,故步驟Ⅱ中滴入的H2O2分別與H2SO3和Br-發生了反應;
(4)電解裝置為電解飽和食鹽水的電解池,很明顯氯堿工業除氯氣外還可得到氫氣和氫氧化鈉,離子交換膜不允許透過OH-,因為如果透過OH-,生成的氯氣會有少量溶解在堿性溶液里,制得的氫氧化鈉不純.
解答 解:(1)儀器A為常見的化學儀器,很容易識別,應為球形冷凝管,故答案為:球形冷凝管;
(2)向反應容器中滴加H2SO3溶液,溴水中的溴會被還原為Br-,溴水為橙黃色,隨著滴加的H2SO3溶液原來越多,溶液里的溴越來越少,顏色會逐漸變淺,最終褪色,步驟Ⅱ滴入過量的H2O2溶液,故剛開始溶液顏色沒有變化,繼續滴加溶液變為橙黃色,說明H2O2氧化了溶液里的Br-生成Br2,發生反應的化學方程式為2H2O2+2HBr=Br2+2H2O,分析氧化還原反應可知H2O2的氧化性大于Br2,
故答案為:由橙黃色變為無色;H2O2的氧化性大于Br2;
(3)步驟Ⅱ最初滴入的H2O2溶液是氧化H2SO3,等H2SO3完全氧化后,再氧化溶液里的Br-,看到溶液逐漸變黃色,最終變橙黃色,發生的反應離子方程式為H2SO3+H2O2=2H++SO42-+H2O、2H++2Br-+H2O2=Br2+2H2O,
故答案為:步驟1的H2SO3有過量,H2O2先和H2SO3反應;H2SO3+H2O2=2H++SO42-+H2O、2H++2Br-+H2O2=Br2+2H2O;
(4)氯堿工業得到的產物是氯氣、氫氣和氫氧化鈉,如果OH-透過交換膜進入陽極區,生成的氯氣會有少量溶解在堿性溶液里,得到的氫氧化鈉不純,且影響產量,
故答案為:NaOH,H2;避免Cl2與NaOH反應生成NaClO,影響NaOH的產量和純度.
點評 本題以氧化還原反應中氧化劑的氧化性大于氧化產物為載體,探究H2O2、H2SO3、Br2氧化性強弱,考查了實驗的基本操作,培養了學生結合實驗現象分析原理的能力,有一定的難度.


科目:高中化學 來源: 題型:選擇題
| A. | 堿性氧化物一定是金屬氧化物 | |
| B. | 金屬氧化物一定是堿性氧化物 | |
| C. | 酸性氧化物、堿性氧化物一定都能與水反應生成相應的酸、堿 | |
| D. | 酸性氧化物一定是非金屬氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 普通鋅錳干電池碳棒是負極,鋅片是正極 | |
| B. | 盛水的鐵器,在空氣與水交界處更容易銹蝕 | |
| C. | 為防止金屬的腐蝕可在金屬表面涂油漆、油脂 | |
| D. | 用鹽酸與鋅反應制取氫氣,含有雜質的鋅比純鋅產生氫氣速度快 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 金屬離子 | 完全沉淀pH |
| Fe2+ | 9.7 |
| Mg2+ | 12.4 |
| Fe3+ | 3.2 |
| Al3+ | 5.2 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知:①CH3CH2OH$→_{170℃}^{濃H_{2}SO_{4}}$CH2=CH2↑+H20,CH2=CH2+Br2→BrCH2-CH2Br
已知:①CH3CH2OH$→_{170℃}^{濃H_{2}SO_{4}}$CH2=CH2↑+H20,CH2=CH2+Br2→BrCH2-CH2Br| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 通常狀況下的狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 熔點/℃ | -130 | 9 | -116 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
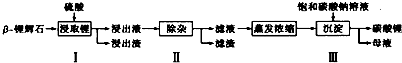
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 25℃時,三種酸的電離常數為:
25℃時,三種酸的電離常數為:| 化學式 | CH3COOH | H2CO3 | HClO |
| 電離平衡常數K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 現象 | 解釋或結論 |
| A | 某溶液加CCl4,振蕩、靜置 | 下層溶液顯紫色 | 原溶液中一定有I2 |
| B | 向樣品溶液中先滴加過量的稀鹽酸,再滴加BaCl2溶液 | 滴加稀鹽酸無現象,滴加BaCl2后出現白色沉淀. | 說明樣品溶液中一定含有SO42- |
| C | 向某溶液中加入硝酸銀,再加入稀硝酸 | 有白色沉淀 | 原溶液中有Cl- |
| D | 向某溶液中加入稀硫酸 | 生成無色氣體 | 說明原溶液中一定有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com