
| A. | 中國古代利用明礬溶液的酸性清除銅鏡表面的銅銹 | |
| B. | 服用阿司匹林出現水楊酸反應時,用NaHCO3溶液解毒 | |
| C. | 石油裂解、煤的干餾、玉米制醇、蛋白質的變性和納米銀粒子的聚集都是化學變化 | |
| D. | 燃料的脫硫脫氮、SO2的回收利用和NOx的催化轉化都是減少酸雨產生的措施 |
分析 A.明礬溶液中Al3+水解使溶液呈酸性,銅銹為Cu2(OH)2CO3,溶于酸性溶液;
B.水楊酸為鄰羥基苯甲酸,含有羧基、酚羥基,羧基能與碳酸氫鈉反應;
C.納米粒子是指粒度在1-100nm之間的粒子,與膠體相同,膠體的聚沉屬于物理變化;
D.二氧化硫、二氧化氮是形成酸雨的主要物質.
解答 解:A.明礬溶液中Al3+水解使溶液呈酸性,銅銹為Cu2(OH)2CO3,溶于酸性溶液,故利用明礬溶液的酸性清除銅鏡表面的銅銹,故A正確;
B.水楊酸為鄰羥基苯甲酸,含有羧基、酚羥基,羧基能與碳酸氫鈉反應生成二氧化碳,服用阿司匹林出現水楊酸反應時,可以用NaHCO3溶液解毒,故B正確;
C.石油裂解、煤的干餾、玉米制醇、均有新物質生成,屬于化學變化,但是納米銀粒子的聚集屬于小顆粒的膠體離子變成大顆粒聚成下來,沒有新物質生成,蛋白質的變性也可能屬于物理變化,故C錯誤;
D.采用燃料脫硫技術可以減少二氧化硫的產生,從而防止出現酸雨,NOx的催化轉化生成無污染的氮氣也是減少酸雨的有效措施,故D正確.
故選C.
點評 本題考查化學與生產、生活的關系,題目難度不大,要求學生能夠用化學知識解釋化學現象,試題培養了學生的分析、理解能力及靈活應用基礎知識的能力.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:解答題
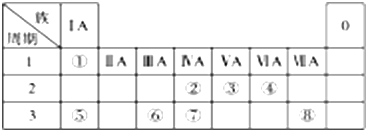
 HClO+H++Cl-.
HClO+H++Cl-.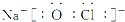 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ④ | ⑤ | ||||||
| 3 | ① | ② | ③ | ⑥ | ⑦ | ⑧ |
| 實驗步驟 | 實驗現象 |
| A、將一小塊單質①放入滴有酚酞溶液 的冷水中 | 劇烈反應,①浮于水面上,熔成小球,四處游動,發出“嘶嘶”聲,隨之消失,溶液變成紅色 |
| B、將單質②投入冷水中,觀察現象, 再將水加熱 | 開始無現象,加熱后有氣體產生 |
| C、將單質②投入稀鹽酸中 | 迅速產生大量無色氣體 |
| D、將單質③投入稀鹽酸中 | 反應不十分劇烈,產生無色氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2 | B. | 2:1 | C. | 1:4 | D. | 4:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ,比釩質子數大1的元素原子的電子排布式為1s22s22p63s23p63d54s1.
,比釩質子數大1的元素原子的電子排布式為1s22s22p63s23p63d54s1.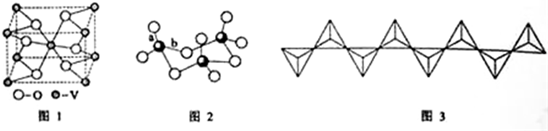
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | FeS+濃HNO3 | B. | Cu+濃HNO3 | C. | FeO+HNO3 | D. | Fe2O3+HNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
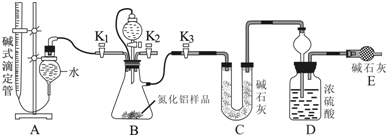
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com