
I.短周期元素X、Y、Z、W在元素周期表中相對位置如圖所示,其中Y所處的周期序數與族序數相等。按要求回答下列問題:

(1)寫出X的原子結構示意圖_______________。
(2)列舉一個事實說明W非金屬性強于Z: _______________(用化學方程式表示)。
(3)含Y的某種鹽常用作凈水劑,其凈水原理是__________(用離子方程式表示)。
II.運用所學化學原理,解決下列問題:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同學利用單質硅和鐵為電極材料設計原電池(NaOH為電解質溶液),該原電池負極的電極反應式為_________________。
(5)已知:①C(s)+ O2(g)=CO2(g)?  H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)
H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)  H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?
H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?  H=c kJ· mol-1。工業上生產粗硅的熱化學方程式為____________。
H=c kJ· mol-1。工業上生產粗硅的熱化學方程式為____________。
(6)已知:CO(g)+H2O(g) H2(g) + CO2(g)。右表為該反應在不同溫度時的平衡常數。則:該反應的
H2(g) + CO2(g)。右表為該反應在不同溫度時的平衡常數。則:該反應的 H________0(填“<”或“>”);500℃時進行該反應,且CO和H2O起始濃度相等,CO平衡轉化率為_________。
H________0(填“<”或“>”);500℃時進行該反應,且CO和H2O起始濃度相等,CO平衡轉化率為_________。

(1)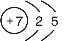 (2分)(2)2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(3分)
(2分)(2)2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(3分)
(3)Al3++3H2O Al(OH)3+3H+(2分)(4)Si-4e-+6OH-=SiO32-+3H2O(3分)
Al(OH)3+3H+(2分)(4)Si-4e-+6OH-=SiO32-+3H2O(3分)
(5)2C(s)+SiO2(s)=Si(s)+2CO(g) △H=(a+b-c)kJ·mol-1(3分) (6)<(1分)?? 75%(3分)
【解析】
試題分析:根據短周期元素X、Y、Z、W在元素周期表中相對位置可知,X位于第二周期,Y、Z、W位于第三周期。其中Y所處的周期序數與族序數相等,所以Y是第三周期第ⅢA族元素,即Y是鋁,則Z是Si,X是N,W是Cl。
(1)氮元素的原子序數是7,則氮元素的原子結構示意圖為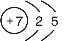 。
。
(2)判斷非金屬性強弱的一般規律是:①由元素原子的氧化性判斷:一般情況下,氧化性越強,對應非金屬性越強。②由單質和酸或者和水的反應程度判斷:反應越劇烈,非金屬性越強。③由對應氫化物的穩定性判斷:氫化物越穩定,非金屬性越強。④由和氫氣化合的難易程度判斷:化合越容易,非金屬性越強。⑤由最高價氧化物對應水化物的酸性來判斷:酸性越強,非金屬越強。(除氟元素之外)。⑥由對應陰離子的還原性判斷:還原性越強,對應非金屬性越弱。⑦由置換反應判斷:強置弱。〔若依據置換反應來說明元素的非金屬性強弱,則非金屬單質應做氧化劑,非金屬單質做還原劑的置換反應不能作為比較非金屬性強弱的依據〕。⑧按元素周期律,同周期元素由左到右,隨核電荷數的增加,非金屬性增強;同主族元素由上到下,隨核電荷數的增加,非金屬性減弱。⑨非金屬單質與具有可變價金屬的反應。能生成高價金屬化合物的,其非金屬性強。因此可以根據高氯酸能制備硅酸來驗證W非金屬性強于Z,反應的化學方程式為2HClO4+Na2SiO3=2NaClO4+H2SiO3↓。
(3)明礬溶于水電離出的鋁離子水解生成氫氧化鋁膠體,膠體具有吸附性,因此明礬可以作凈水劑,反應的離子方程式為Al3++3H2O Al(OH)3+3H+。
Al(OH)3+3H+。
(4)原電池中負極失去電子,發生氧化反應。所以根據反應式Si+2NaOH+H2O=Na2SiO3+2H2可知,如果利用單質硅和鐵為電極材料設計原電池(NaOH為電解質溶液),則硅是負極,因此該原電池負極的電極反應式為Si-4e-+6OH-=SiO32-+3H2O。
(5)已知:①C(s)+ O2(g)=CO2(g)? △H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g) △H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)? △H=c kJ· mol-1,則根據蓋斯定律可知①+②-③即得到工業上生產粗硅的熱化學方程式,即為2C(s)+SiO2(s)=Si(s)+2CO(g) △H=(a+b-c)kJ·mol-1。
(6)根據表中數據可知,隨著溫度的升高,平衡常數逐漸減小。這說明升高溫度平衡向逆反應方向移動,因此正方應是放熱反應,即△H<0;設CO和H2O起始濃度分別為a,則
???????????? CO(g)+H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始濃度??? a????? a????????? 0??????? 0
轉化濃度??? b????? b????????? b??????? b
平衡濃度? a-b??? a-b??????? b??????? b
所以根據平衡常數表達式可知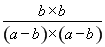 =9
=9
解得b=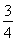 a
a
所以CO平衡轉化率為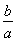 ×100%=75%
×100%=75%
考點:考查元素推斷、非金屬性強弱比較、蓋斯定律應用、原電池應用以及可逆反應的有關判斷與計算


 新思維假期作業寒假吉林大學出版社系列答案
新思維假期作業寒假吉林大學出版社系列答案科目:高中化學 來源: 題型:



| ||
| ||

查看答案和解析>>
科目:高中化學 來源: 題型:

 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
| X | ||
| Y | Z |
| 溫度/℃ | 500 | 700 | 850 | 1 000 |
| 平衡常數 | 2.5 | 1.7 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:
短周期元素X、Y、Z的原高考資源網子序數依次增大,X和Y同主族,Y和Z同周期,Y與Z能形成離子個數比為1︰1的離子化合物A,X與Z能形成原子個數比為1︰1的共價化合物B,它們之間能實現如下圖所示轉化(部分產物已略去):
(1)Y在周期表的位置是______________________;Z2的結構式是________。
(2)反應①的離子方程式____________________________________________。
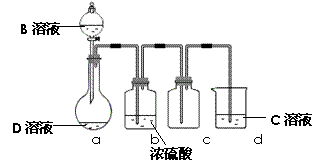 (3)D是很多漂白劑中含有的有效成分,這些產品不能與潔廁靈(含有有機酸和無機酸)一起使用,其原因就是在常溫時能發生與反應②相似的反應。某校的學生在實驗室利用反應②的原理來制備純凈、干燥的Z2,儀器裝置如右圖所示(夾持固定裝置的儀器已略去)。
(3)D是很多漂白劑中含有的有效成分,這些產品不能與潔廁靈(含有有機酸和無機酸)一起使用,其原因就是在常溫時能發生與反應②相似的反應。某校的學生在實驗室利用反應②的原理來制備純凈、干燥的Z2,儀器裝置如右圖所示(夾持固定裝置的儀器已略去)。
I、寫出反應②的離子方程式_____________________
II、上述實驗裝置不夠完善,改進方法是
Ⅲ、足量Z2 通入FeBr2溶液中發生反應的離子方程式是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com