
| c(標準)×V(標準) |
| V(待測) |
| c(標準)×V(標準) |
| V(待測) |
| c(標準)×V(標準) |
| V(待測) |
| c(標準)×V(標準) |
| V(待測) |


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2012屆浙江省紹興一中高三5月模擬考試理科綜合化學試卷(帶解析) 題型:填空題
(15分)某研究小組對一元有機弱酸HA在溶劑苯和水的混合體系中溶解程度進行研究。在25℃時,弱酸HA在水中部分電離,HA的電離度為0.10;在苯中部分發生雙聚,生成(HA)2。該平衡體系中,一元有機弱酸HA在溶劑苯(B)和水(W)中的分配系數為K,K=C(HA)B/C(HA)W=1.0,即達到平衡后,以分子形式存在的HA在苯和水兩種溶劑中的比例為1∶1;已知:lg2=0.3,lg3=0.5 其他信息如下:
| 25℃平衡體系(苯、水、HA) | 平衡常數 | 焓變 | 起始總濃度 |
| 在水中,HA === H++A- | K1 | △H1 | 3.0×10-3 mol·L-1 |
| 在苯中,2HA == (HA)2 | K2 | △H2 | 4.0×10-3 mol·L-1 |
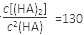 ,則反應向_______方向進行。
,則反應向_______方向進行。 (HA)2,已知該二聚反應的反應熱數值約為活化能的5/9 。下列能量關系圖最合理的是 。
(HA)2,已知該二聚反應的反應熱數值約為活化能的5/9 。下列能量關系圖最合理的是 。
 (HA)2的平衡常數K2均變大。
(HA)2的平衡常數K2均變大。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省高三5月模擬考試理科綜合化學試卷(解析版) 題型:填空題
(15分)某研究小組對一元有機弱酸HA在溶劑苯和水的混合體系中溶解程度進行研究。在25℃時,弱酸HA在水中部分電離,HA的電離度為0.10;在苯中部分發生雙聚,生成(HA)2。該平衡體系中,一元有機弱酸HA在溶劑苯(B)和水(W)中的分配系數為K,K=C(HA)B/C(HA)W=1.0,即達到平衡后,以分子形式存在的HA在苯和水兩種溶劑中的比例為1∶1;已知:lg2=0.3,lg3=0.5 其他信息如下:
|
25℃平衡體系(苯、水、HA) |
平衡常數 |
焓變 |
起始總濃度 |
|
在水中,HA === H++A- |
K1 |
△H1 |
3.0×10-3 mol·L-1 |
|
在苯中,2HA == (HA)2 |
K2 |
△H2 |
4.0×10-3 mol·L-1 |
回答下列問題:
(1)計算25℃時水溶液中HA的電離平衡常數K1= 。
(2)25℃,該水溶液的pH為 ,在苯體系中HA的轉化率為__________。
(3)25℃混合體系中,HA在苯中發生二聚,若測得某時刻溶液中微粒濃度滿足 ,則反應向_______方向進行。
,則反應向_______方向進行。
(4)在苯中,HA自發進行發生二聚:2HA (HA)2, 已知該二聚反應的反應熱數值約為活化能的5/9 。下列能量關系圖最合理的是
。
(HA)2, 已知該二聚反應的反應熱數值約為活化能的5/9 。下列能量關系圖最合理的是
。

(5)下列有關該混合體系說法不正確的是 。
A.用分液漏斗分離得到水溶液和苯溶液,若水溶液中加入少量水,苯溶液中加少量苯,則上述平衡均正移,且c(HA)均減小。
B.升高溫度,HA的電離平衡常數K1和2HA  (HA)2的平衡常數K2均變大。
(HA)2的平衡常數K2均變大。
C.若用酸堿中和滴定的分析方法,可以測出HA的起始總濃度。
D.在25℃時,若再加入一定量的HA固體,則水和苯中HA的起始總濃度之比仍為3:4。
(6)在25℃時,用0.1000mol/L氫氧化鈉溶液滴定20.00mL 0.1000mol/L HA水溶液,請在下圖中畫出滴定曲線示意圖。

查看答案和解析>>
科目:高中化學 來源: 題型:
①用量筒量取濃鹽酸配制0.01 mol·L-1稀鹽酸時,量筒用蒸餾水洗凈后未經干燥直接量取濃鹽酸 ②配制稀鹽酸定容時,俯視容量瓶刻度線 ③滴定結束時,讀數后發現滴定管下端尖嘴處懸掛有一滴液滴 ④滴定過程中用少量蒸餾水將錐形瓶內壁粘附的鹽酸沖下
A.僅①③ B.僅②④ C.僅②③④ D.①②③④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com